
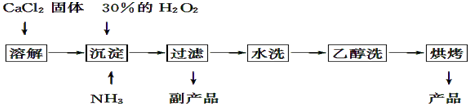
分析 (1)根据图示流程中找出反应物、生成物,写出反应的化学方程式,由工艺流程可知,反应②为氯化钙与氨水、过氧化氢反应生成CaO2•8H2O,还应生成氯化铵;
(2)根据(1)的反应方程式可知,该制法的副产品为氯化铵,为了提高副产品的产率,不引入新杂质,结晶前用盐酸将溶液的pH调整到合适范围;
(3)通过检验洗涤液中是否含有氯离子来判断检验“水洗”是否合格;
(4)①在酸性条件下,CaO2能将碘离子氧化成碘单质,根据电荷守恒和元素守恒书写离子方程式;
②Na2S2O3溶液呈碱性,所以要用碱式滴定管进行滴定,根据滴定结束前溶液为蓝色,滴定结束是溶液由蓝色变成无色分析;
③根据电子守恒及化学反应方程式找出过氧化钙与硫代硫酸钠反应的关系式,再根据题中数据计算出样品中过氧化钙的质量分数;
解答 解:(1)由流程可知,反应物为氯化钙、双氧水、氨气和水,生成为CaO2•8H2O和氯化铵,反应的化学方程式为:CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl或CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl,
故答案为:CaCl2+H2O2+2NH3+8H2O=CaO2•8H2O↓+2NH4Cl或CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl;
(2)根据(1)的反应方程式可知,该制法的副产品为NH4Cl,为了提高副产品的产率,不引入新杂质,结晶前用盐酸将溶液的pH调整到合适范围,
故答案为:NH4Cl;盐酸;
(3)检验“水洗”是否合格的方法是:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀,
故答案为:取最后一次洗涤液少许于试管中,再滴加稀硝酸酸化的硝酸银溶液,看是否产生白色沉淀;
(4)①在酸性条件下,CaO2能将碘离子氧化成碘单质,反应的离子方程式为CaO2+4H++2I-═Ca2++2H2O+I2,
故答案为:CaO2+4H++2I-═Ca2++2H2O+I2;
②Na2S2O3溶液呈碱性,所以要用碱式滴定管进行滴定,根据滴定结束前溶液为蓝色,滴定结束是溶液由蓝色变成无色,反应完全时的现象为溶液由蓝色变为无色,且30s不恢复,
故答案为:碱式滴定管;溶液由蓝色变为无色,且30s不恢复;
③过氧化钙氧化碘化钾生成的碘单质,用硫代硫酸钠滴定时,消耗的硫代硫酸钠的物质的量为:cmol•L-1×V×10-3L=cV×10-3mol,根据氧化还原反应中电子守恒及题中反应方程式可得关系式:CaO2~I2~2S2O32-,过氧化钙的物质的量为:n(CaO2)=$\frac{1}{2}$n(S2O32-)=$\frac{1}{2}$×cV×10-3mol,
样品中CaO2的质量分数为:$\frac{\frac{1}{2}×cV×10{\;}^{-3}mol×72g/mol}{ag}$×100%=$\frac{36cV×1{0}^{-3}}{a}$×100%=$\frac{3.6cV}{a}$%,
故答案为:$\frac{3.6cV}{a}$%.
点评 本题考查形式为物质制备流程图题目,涉及中和滴定中的误差分析、物质的检验及化学计算等问题,题目难度较大,做题时注意分析题中关键信息、明确实验基本操作方法,本题较为综合,充分考查了学生的分析、化学实验、化学计算能力.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在7.8gNa2O2晶体中阳离子与阴离子总数为0.3NA | |
| B. | 在KIO3+6HI=KI+3I2+3H2O反应中,每生成3mol I2,则转移6NA个电子 | |
| C. | 1mol Na2O2与H2O完全反应,转移的电子总数为NA | |
| D. | 在1L0.1mol/L的碳酸钠溶液中,阴离子总数大于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将分别蘸有浓硝酸和浓氨水的玻璃棒相互靠近时,有白烟生成 | |
| B. | 硝酸具有酸的通性,如果与活泼金属反应,会有H2生成 | |
| C. | 浓硝酸能使活泼金属如铝、镁、锌、铁等发生“钝化” | |
| D. | 常温下,铜与稀HNO3反应很慢,是因为发生了“钝化” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
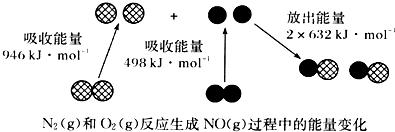
| A. | 1molN2(g)和NA个O2(g)反应放出的能量为180 kJ | |
| B. | 1molN2(g)和1molO2(g)具有总能量小于2molNO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| D. | 吸热反应一定需要加热才能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.
连二亚硫酸钠(Na2S2O4)又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验.| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、植物油和苯都能与氢气发生加成反应,是因为其结构中都含有碳碳双键 | |
| B. | 开发核能、太阳能等新能源,推广甲醇汽油,使用无磷洗涤剂都可直接降低碳排放 | |
| C. | 红外光谱仪、核磁共振仪、质谱仪都可用于有机化合物结构的分析 | |
| D. | 制造玻璃是复杂的物理变化,玻璃的组成不同,性能不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
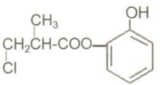
| A. | 有机物A与浓硫酸混合加热,可以发生消去反应 | |
| B. | 1molA和足量的H2发生加成反应,最多可以消耗4molH2 | |
| C. | 1molA和足量NaOH溶液发生反应,最多可以消耗 4molNaOH | |
| D. | 有机物A不能在稀硫酸下水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向KBr溶液中加入CCl4和氯水 | CCl4层呈红色 | 氧化性:Cl2>Br2 |
| B | 向难溶的PbSO4加入CH3COONH4溶液 | 得到无色溶液 | (CH3COO)2Pb是弱电解质 |
| C | 向KNO3和KOH的混合溶液中加入Al,微热,关口放湿润的红色石蕊试剂 | 试剂变为蓝色 | NO3-被还原为NH3 |
| D | 高温加热炭粉于Fe2O3的混合物 | 产物能被磁铁吸引 | 产物中含有Fe或Fe3O4中的一种或两种 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气的燃烧热为285.5KJ/mol,则电解水的热化学方程式为2H2O(l)$\frac{\underline{\;电解\;}}{\;}$ 2H2(g)+O2(g)△H=+285.5KJ/mol | |
| B. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3KJ/mol 则稀H2SO4溶液和稀Ba(OH)2溶液反应的反应热△H=2×(-57.3)KJ/mol | |
| C. | 在CO2中,Mg燃烧生成MgO和C,该反应中化学能全都转化为热能 | |
| D. | 已知AX3的熔点和沸点分别为一93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 KJ/mol.该反应的热化学方程式为AX3(l)+X2(g)═AX5(s)△H=一123.8 KJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com