
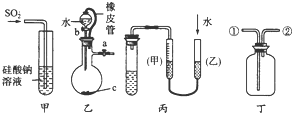
| A、甲装置:可用来证明硫的非金属性比硅强 |
| B、乙装置:橡皮管的作用是能使水顺利流下 |
| C、丙装置:用图示的方法能检查此装置的气密性 |
| D、丁装置:可在瓶中先装入某种液体收集NO气体 |


科目:高中化学 来源: 题型:
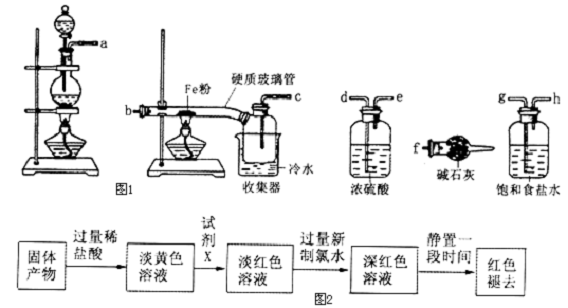
查看答案和解析>>
科目:高中化学 来源: 题型:
| 甲 | 乙 | 丙 | |
| 合金质量/mg | 510 | 765 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
查看答案和解析>>
科目:高中化学 来源: 题型:
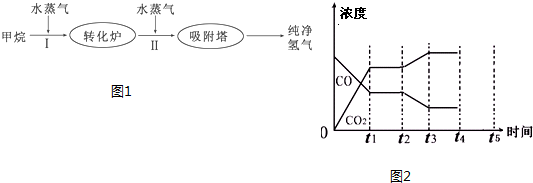
| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和苯都能使溴水褪色,褪色的原因相同 |
| B、分子式为C2H4O2且能与NaOH溶液反应的有机物一定是乙酸 |
| C、油脂和纤维素都是能发生水解反应的高分子化合物 |
| D、甲烷、苯、乙醇、乙酸和酯类都可以发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
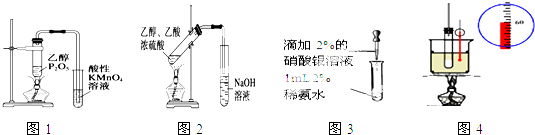
| A、图1可证明乙醇发生消去反应生成了乙烯 |
| B、图2用于实验室制备乙酸乙酯 |
| C、图3用于配制银氨溶液 |
| D、图4用于实验室制硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
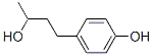 最近我国质检总局通报,日本佳丽宝公司生产的化妆品使用后皮肤会出现白斑,其中的有害成分为杜鹃醇(结构如图),有关杜鹃醇的说法不正确的是( )
最近我国质检总局通报,日本佳丽宝公司生产的化妆品使用后皮肤会出现白斑,其中的有害成分为杜鹃醇(结构如图),有关杜鹃醇的说法不正确的是( )| A、分子式为:C10H14O2 |
| B、水溶液酸性一定比碳酸强 |
| C、能与FeCl3溶液发生显色反应 |
| D、最多可与含3molBr2的溴水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
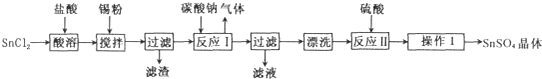
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | Fe3+有氧化性 | FeCl3溶液可溶解废旧电路板中的铜 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | NH3有还原性 | NH3可用H2SO4吸收 |
| D | 浓HNO3有酸性 | 浓HNO3不可用铁制容器盛放 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com