
| A. | 密度大小 | B. | 容易导电 | C. | 延展性好 | D. | 易导热 |
科目:高中化学 来源: 题型:解答题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 试管1 | 17.5 | 34.9 | 50.1 | 60.3 | 70.4 | 80.2 | 84.9 | 85.2 | 85.4 |
| 试管2 | 21.7 | 41.2 | 57.5 | 70.8 | 81.3 | 84.9 | 85.3 | 85.4 | 85.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:F->Na+>Mg2+>Al3+ | B. | 热稳定性:HF>H2O>H2S | ||
| C. | 还原性:F-<Cl-<I- | D. | 碱性强弱:NaOH>KOH>CsOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属原子间以共价键结合的物质一定是共价化合物 | |
| B. | 凡是含有离子键的化合物一定是离子化合物 | |
| C. | 凡是能电离出离子的化合物一定是离子化合物 | |
| D. | 含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
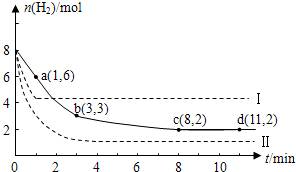
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用硫和硫铁矿均可做为原料 | |
| B. | SO2转化为SO3,需在催化剂和加热条件下进行 | |
| C. | SO3可用水直接吸收 | |
| D. | 热交换器可对生成气体冷却,对原料气体加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com