
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaO(s)+SO2(g)+CO2(g) ΔH1=218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
CaS(s)+4CO2(g) ΔH2=-175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
通过监测反应体系中气体浓度的变化判断反应Ⅰ和Ⅱ是否同时发生,理由是___。
科目:高中化学 来源: 题型:
【题目】(1)加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式是_______。
(2)CoCO3隔绝空气灼烧可以生成Co2O3,该反应的化学方程式为____________。
(3)肼具有很好的还原性,且氧化产物无污染,故可用于除去锅炉等设备供水中的溶解氧等,除去100 L锅炉水中![]() 含氧气8 g/L的溶解氧,需要肼的质量为__________。
含氧气8 g/L的溶解氧,需要肼的质量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
在一密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.保持容器体积不变,增加H2O(g)的量
B.保持容器体积不变,充入氦气使体系压强增大
C.将容器的体积缩小一半
D.保持容器压强不变,充入氦气使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用O2将HCl转化为Cl2,可提高效益,减少污染,
新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性,
在上述实验中若压缩体积使压强增大,画出相应aHCl—T曲线的示意图,并简要说明理由___。
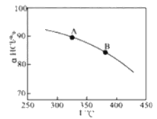
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种药物在临床上有许多的应用,具有去热、镇痛等疗效,以下是该药物的合成路线:
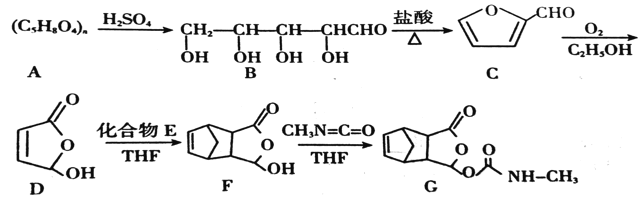
已知:CH2=CH—CH2=CH2+CH2=CH2![]()
(1)化合物C的分子式为__,B中含氧官能团的名称是__。
(2)E的一氯代物有__种,F→G的反应类型为__。
(3)写出D→F的化学方程式__。
(4)F的同分异构体有多种,符合以下条件的同分异构体有__种,写出其中一种的结构简式__。
①属于二取代芳香化合物,苯环上的一氯代物有两种
②能与FeCl3溶液发生显色反应
③能与碳酸氢钠反应产生气体
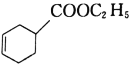
(5)写出由2—溴丁烷、丙烯酸和乙醇为原料合成如图物质的合成路线:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
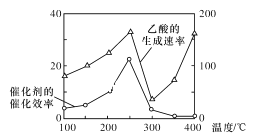
【题目】大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。
以TiO2/Cu2Al2O4为催化剂,可以将CO2和CH4直接转化为乙酸,请写出该反应的化学方程式:____。在不同温度下催化剂的催化效率与乙酸的生成速率的关系如图所示。在温度为____时,催化剂的活性最好,效率最高。请解释图中250~400℃时乙酸生成速率变化的原因:250~300℃时___;300~400℃时___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A.1molN2与3molH2反应生成的NH3分子数为2NA
B.14g乙烯(C2H4)和丙烯(C3H6)混合气体中的原子总数为3NA
C.1molFe溶于过量硝酸,电子转移数为2NA
D.标准状况下,2.24LCCl4含有的共价键数为0.4NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com