
| A. | 霾是一种分散系,分散质是固体 | |
| B. | 雾是一种分散系,分散剂是气体 | |
| C. | 霾属于胶体分散系 | |
| D. | 减少生产生活中产生的扬尘可以减少雾霾天气的形成 |
分析 A.霾分散剂是空气,分散质是空气中的悬浮颗粒物;
B.雾分散剂是空气;
C.霾颗粒较大,不属于胶体分散系;
D.雾霾天气的形成主要来源于扬尘和化石燃料燃烧产生的颗粒物.
解答 解:A.霾分散剂是空气,分散质是空气中的悬浮颗粒物,所以分散质是固体,故A正确;
B.雾分散剂是空气,分散质是水,故B正确;
C.胶体是指分散质粒子直径在1nm-100nm之间的分散系,雾霾不属于气溶胶,它的微粒直径超出了胶体的范围,故C错误;
D.雾霾天气的形成主要来源于化石燃料的燃烧、垃圾焚烧产生的烟尘以及道路和建筑施工的扬尘,所以减少生产生活中产生的扬尘可以减少雾霾天气的形成,故D正确;
故选C.
点评 本题考查环境污染知识,为高频考点,侧重于化学与环境的考查,有利于培养学生的良好的科学素养,提高学习的积极性,注意相关基础知识的积累,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | v正(C):v逆(H2)=1:1的状态 | |
| B. | 用H2O、CO、H2的物质的量浓度变化表示的反应速率的比为1:1:1的状态 | |
| C. | 混合气体的密度不再改变的状态 | |
| D. | 当平衡常数K不发生改变的时候 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、石灰石 | B. | 硝酸、烧碱、胆矾 | ||
| C. | 醋酸、碱式碳酸铜、醋酸钠 | D. | 盐酸、熟石灰、苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
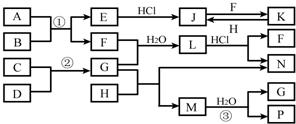 如图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去).
如图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去). ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
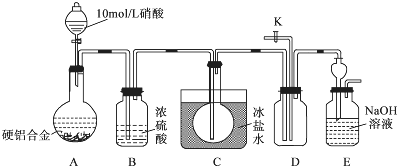
| 金属离子 | 开始沉淀时的pH | 沉淀完全的pH |
| Al3+ | 3.4 | 4.7 |
| Cu2+ | 4.1 | 6.9 |
| Mg2+ | 9.4 | 12.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量水,水的电离平衡向正方向移动 | |
| B. | 加入少量NaHCO3固体,c(ClO-)减小 | |
| C. | 通入少量SO2,溶液漂白性增强 | |
| D. | 加入NaOH固体至溶液呈中性时,c(Na+)═c(Cl-)+c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com