
【题目】有关蛋白质的叙述中不正确的是( )
A.向蛋白质溶液滴加硫酸铜溶液发生盐析
B.蛋白质遇浓硝酸显黄色
C.蛋白质溶液具有丁达尔效应
D.蛋白质的基本结构单元是氨基酸
科目:高中化学 来源: 题型:
【题目】氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1) 以CO2与NH3为原料合成化肥尿素的主要反应如下:
① 2NH3(g)+CO2(g)=NH2CO2NH4(s);ΔH=-159.47 kJ·mol1
② NH2CO2NH4(s)=CO (NH2)2(s)+H2O(g);ΔH=a kJ·mol1
③ 2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g);ΔH=-86.98 kJ·mol1
则a为____。
(2) 尿素可用于湿法烟气脱氮工艺,其反应原理为:NO+NO2+H2O=2HNO2;2HNO2+CO(NH2)2=2N2↑+CO2↑+3H2O。
① 当烟气中NO、NO2按上述反应中系数比时脱氮效果最佳。若烟气中V(NO)∶V(NO2)=5∶1时,可通入一定量的空气,同温同压下,V(空气)∶V(NO)=____(空气中氧气的体积含量大约为20%)。
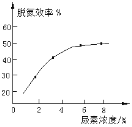
② 如图表示尿素含量对脱氮效率的影响,从经济因素上考虑,一般选择尿素浓度约为____%。
(3)用稀硝酸吸收NOx,得到HNO3和HNO2(弱酸)的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:____。
(4)利用脱氮菌可净化低浓度NO废气。当废气在塔内停留时间均为90s的情况下,测得不同条件下NO的脱氮率如图所示。
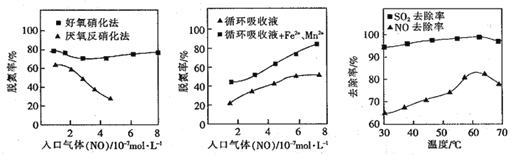
① 由图知,当废气中的NO含量增加时,宜选用____法提高脱氮的效率。
② 图Ⅱ中,循环吸收液加入Fe2+、Mn2+,提高了脱氮的效率,其可能原因为____。
(5)研究表明:NaClO/H2O2酸性复合吸收剂可同时有效脱硫、脱硝。图所示为复合吸收剂组成一定时,温度对脱硫脱硝的影响。温度高于60℃后,NO去除率下降的原因为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】解释下列事实所用的方程式不合理的是
A. 硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 +4H+=2I2+2H2O
B. 将充有NO2的玻璃球浸到热水中,气体颜色加深:2NO2(g)![]() N2O4(g) △H>0
N2O4(g) △H>0
C. 用Na2CO3溶液处理锅炉水垢中的硫酸钙:CO32- +CaSO4 =CaCO3 +SO42-
D. 以KOH溶液为电解质溶液,氢氧燃料电池的负极区pH减小:H2+2OH--2e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图装置进行实验,下列推断正确的是( )
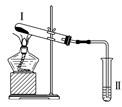
选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素的原子序数X>W>Z>Y.W原子的最外层没有p电子,X原子核外s电子与p电子数之比为1:1,Y原子最外层s电子与p电子数之比为1:1,Z原子核外电子中p电子数比Y原子多2个.
(1)X元素的单质与Z、Y所形成的化合物反应,其化学方程式:__________________.
(2)W、X元素的最高价氧化物对应水化物的碱性强弱为__________(用分子式表示).
(3)四种元素原子半径的由大到小为_________(填元素符号).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(![]() ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A–。已知25 ℃时,HA的Ka=6.25×10–5,H2CO3的Ka1=4.17×10–7,Ka2=4.90×10–11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)( )
A. 相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B. 当pH为5.0时,饮料中c(HA) /c(A–)=0.16
C. 提高CO2充气压力,饮料中c(A–)不变
D. 碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3-)+c(CO32-)+c(OH–)–c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某红色固体粉末样品可能含有Fe2O3和Cu2O中的一种或两种,某校化学自主探究实验小组拟对其组成进行探究。查阅资料:Cu2O在酸性溶液中会发生反应:Cu2O+2H+===Cu+Cu2++H2O。
实验探究一 学生甲利用如图所示装置进行实验,称量反应前后装置C中样品的质量,以确定样品的组成。回答下列问题:
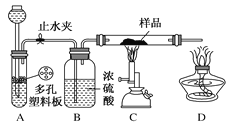
(1)仪器组装完成后,夹好止水夹,_________________,则说明装置A的气密性良好。
(2)从下列实验步骤中,选择正确的操作顺序:__________________(填序号)。
①打开止水夹 ②熄灭C处的酒精喷灯 ③C处冷却至室温后,关闭止水夹 ④点燃C处的酒精喷灯 ⑤收集氢气并验纯
实验探究二
(3)学生乙取少量样品于烧杯中,加入过量稀硫酸,并作出如下假设和判断,结论正确的是________(填选项字母)。
A.若固体全部溶解,说明样品中一定含有Fe2O3,一定不含有Cu2O
B.若固体部分溶解,说明样品中一定含有Cu2O,一定不含有Fe2O3
C.若固体全部溶解,再滴加KSCN溶液,溶液不变红色,说明样品一定含有Fe2O3和Cu2O
另取少量样品于试管中,加入适量的浓硝酸,产生红棕色气体证明样品中一定含有________,写出产生上述气体的化学方程式:______________________。
实验探究三
(4)学生丙取一定量样品于烧杯中,加入足量的稀硫酸,反应后经过滤得到固体3.2 g,测得滤液中Fe2+有1.0 mol,则样品中n(Cu2O)=___ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 1mol H2SO4的质量为98g/mol
B. 水的摩尓质量是18g
C. 物质的量既可以表示物质的数量,又可以表示物质的质量
D. 23g金属钠中含有的电子的物质的量为11mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com