
分析 (1)第n周期元素,电子层数为n,m主族最外层电子数为m,m≤n的元素为金属元素,所以第n周期有n种主族金属元素,8-n种非金属元素;
(2)属于非金属元素时n<m,则m主族有m-2种非金属元素;
(3)第二-六周期的最后一种金属分别出现在ⅡA(Be)、ⅢA(Al)、ⅣA(Ge)、ⅤA(Sb)、ⅥA(Po),即主族序号与周期序号相同,则可预测第七周期ⅦA、第八周期ⅧA族元素将是它们所在周期的最后一种金属;这样,第一周期全是非金属(H、He),第八周期全是金属,非金属共有2+6+5+4+3+2+1+0=23种,目前已发现22种,还有1种未发现,应位于第七周期ⅧA(0)族.
解答 解:(1)第n周期元素,电子层数为n,m主族最外层电子数为m,m≤n的元素为金属元素,所以第n周期有n种主族金属元素,8-n种非金属元素,故答案为:n;8-n;
(2)属于非金属元素时n<m,则m主族有m-2种非金属元素,故答案为:m-2;
(3)第二-六周期的最后一种金属分别出现在ⅡA(Be)、ⅢA(Al)、ⅣA(Ge)、ⅤA(Sb)、ⅥA(Po),即主族序号与周期序号相同,则可预测第七周期ⅦA、第八周期ⅧA族元素将是它们所在周期的最后一种金属;这样,第一周期全是非金属(H、He),第八周期全是金属,非金属共有2+6+5+4+3+2+1+0=23种,目前已发现22种,还有1种未发现,所以每一周期只有(8-n)种非金属,故答案为:1; 每一周期只有(8-n)种非金属(除第一周期).
点评 本题考查元素的位置结构性质关系及应用,题目难度较大,要求同学们在学习中要注意把握相关周期律的递变规律,题目信息中给出一定的规律性的东西,注意把握和归纳.


科目:高中化学 来源: 题型:解答题
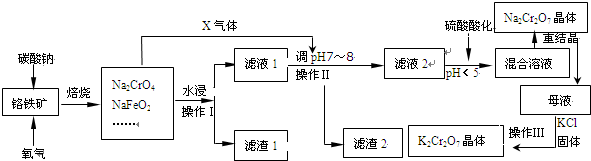
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| B. | 氯化亚铁溶液中加入硝酸:Fe2++4H++NO3-=Fe3++2H2O+NO↑ | |
| C. | 氯气通入冷的氢氧化钠溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O | |
| D. | 氨水中通入过量CO2:2NH3•H2O+CO2=2NH4++CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀H2SO4 | B. | CuSO4溶液 | C. | AgNO3溶液 | D. | Fe2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
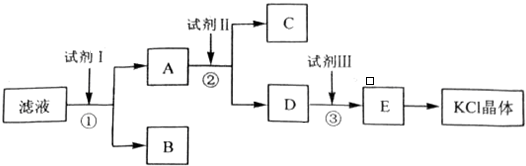
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 s内,v(B)=0.075 mol/(L•s) | |
| B. | 4 s后平衡状态下,c(A):c(C)=2:1 | |
| C. | 达到平衡状态时,若只升高温度,则C的物质的量浓度增大 | |
| D. | 达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P原子:1s2 Q原子:2s2 | |
| B. | P原子:M电子层上有2个电子 Q原子:N电子层上有2个电子 | |
| C. | P原子:2p能级上有1个未成对电子 Q原子:3p能级上有1个未成对电子 | |
| D. | P原子:最外电子层L层上只有一个空轨道 Q原子:3P能级上只有一个空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| B. | 用双氧水分解制取0.1mol氧气,转移的电子总数为0.4×6.02×1023 | |
| C. | 0.1molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 | |
| D. | 28gN2和CO的混合气体中含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验Ⅰ:振荡后静置,上层溶液颜色保持不变 | |
| B. | 实验Ⅱ:酸性KMnO4溶液中无明显现象 | |
| C. | 实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 实验Ⅳ:继续煮沸溶液至红褐色,停止加热,当光束通过体系时可产生丁达尔效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com