【答案】
分析:(1)由题意,若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素,确定A单质是碳,根据碳的化学性质及框图中A能和少量E与过量E反应生成两种含碳化合物B和D,可推测E是氧气,B为CO
2、D为CO,再解答问题;
CO
2通入NaOH溶液中发生两个反应:CO
2+NaOH(少量)═NaHCO
3、CO
2+2NaOH(过量)═Na
2CO
3+H
2O.根据CO
2和NaOH量的关系,确定CO
2少量,NaOH过量,最后溶质有Na
2CO
3和NaOH,求出物质的量之比即可;
热化学方程式书写要求标明各物质的状态、热量用△H表示、放热用符号“-”、吸热用符号“+”、单位为kJ/mol,各物质前的计量数表示物质的量,注意热量随着计量数而改变;
(2)若A为第三周期中的元素所形成的氯化物.可能为NaCl、MgCl
2、AlCl
3中的一种,根据A能和少量E与过量E反应生成两种化合物B和D,即可推断A为AlCl
3,E为含OH
-的碱,发生离子反应Al
3++3OH
-═Al(OH)
3↓、Al
3++4OH
-=AlO
2-+2H
2O,确定出B中含有AlO
2-,D为Al(OH)
3;
(3)若A为常见的金属,在E的冷、浓溶液中,A有钝化现象.能发生钝化现象的金属有Fe和Al,即可确定A为Fe.结合A能和少量E与过量E反应生成两种化合物B和D,即可确定A为Fe,E为硝酸,硝酸具有强氧化性,铁与过量硝酸反应生成Fe
3+,铁与少量硝酸反应生成Fe
2+,所以B中含Fe
3+,D中含Fe
2+.根据已知信息,X为含有非极键的离子化合物,且1mol X含有38mol电子,非极性键是由两个相同非金属原子通过共用电子对形成的,常见的为-O-O-非极性键,氧原子含8个电子,2个氧原子共含16个电子,而X含有38mol电子,还相差22个电子,可考虑含2个Na,即得X为Na
2O
2.Na
2O
2具有强氧化性,可把Fe
2+氧化成Fe
3+,根据题意,向Fe
2+溶液中加入与Fe
2+等物质的量的Na
2O
2固体,恰好完全反应,反应过程可看成Na
2O
2先与水反应,生成的NaOH再与Fe
2+反应,生成Fe(OH)
2,最后Fe(OH)
2再被氧化成Fe(OH)
3.
解答:解:(1)①由题意,若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素,确定A单质是碳,碳元素是自然界中形成化合物种类最多的元素.根据碳的化学性质及框图中A能和少量E与过量E反应生成两种含碳化合物B和D,可推测E是氧气,反应为C+O
2(过量)

CO
2,C+O
2(少量)

2CO,即得B为CO
2、D为CO.CO
2中碳原子最外层4个电子,氧原子最外层6个电子,碳原子分别与两个氧原子各形成两对共用电子对,即电子式为

,结构式为O═C═O,键角180°正电荷重心和负电荷重心重合,所以为非极性分子,由电子式可知CO
2分子中各原子最外层都满足8电子结构.
故答案为:非极性;是;
②CO
2通入NaOH溶液中发生两个反应:CO
2+NaOH(少量)═NaHCO
3、CO
2+2NaOH(过量)═Na
2CO
3+H
2O,
根据题意,n(NaOH)=4mol/L×0.05L=0.2mol,n(CO
2)=

=0.05mol,可见NaOH过量,CO
2全部反应掉,
发生反应CO
2+2NaOH(过量)═Na
2CO
3+H
2O.0.05molCO
2消耗0.1molNaOH,生成0.05molNa
2CO
3,溶液中还剩余0.1molNaOH,
所以溶液中溶质为0.05molNa
2CO
3、0.1molNaOH,n(Na
2CO
3):n(NaOH)=1:2,
故答案为:n(Na
2CO
3):n(NaOH)═1:2;
③4g 碳单质,物质的量为1/3mol,完全燃烧放出131.2kJ的热量,则1mol碳单质完全燃烧放出131.2kJ×3的热量,热化学方程式为C(s)+O
2(g)=CO
2(g)△H=-393.6kJ/mol,
故答案为:C(s)+O
2(g)=CO
2(g)△H=-393.6kJ/mol;
(2)①若A为第三周期中的元素所形成的氯化物.可能为NaCl、MgCl
2、AlCl
3中的一种,根据A能和少量E或过量E反应生成两种化合物B和D,即可推断A为AlCl
3,E为含OH
-的碱,发生离子反应Al
3++3OH
-═Al(OH)
3↓、Al
3++4OH
-=AlO
2-+2H
2O,确定出B中含有AlO
2-,D为Al(OH)
3.则A溶液→B的离子方程式为Al
3++4OH
-=AlO
2-+2H
2O,
故答案为:Al
3++4OH
-=AlO
2-+2H
2O;
②A为AlCl
3,B中含有AlO
2-,在两溶液中,Al
3+和AlO
2-都能发生水解反应,当两溶液混合后,Al
3+和AlO
2- 发生双水解反应生成氢氧化铝沉淀,反应为Al
3++3AlO
2-+6H
2O=4Al(OH)
3↓.
故答案为:Al
3++3AlO
2-+6H
2O=4Al(OH)
3↓;
(3)A为常见的金属,在E的冷、浓溶液中,A有钝化现象.能发生钝化现象的金属有Fe和Al,结合A能和少量E与过量E反应生成两种化合物B和D,即可确定A为Fe,E为硝酸,硝酸具有强氧化性,铁与过量硝酸反应生成Fe
3+,铁与少量硝酸反应生成Fe
2+,所以B中含Fe
3+,D中含Fe
2+.根据已知信息,X为含有非极键的离子化合物,且1mol X含有38mol电子,非极性键是由两个相同非金属原子通过共用电子对形成的,常见的为-O-O-非极性键,氧原子含8个电子,2个氧原子共含16个电子,而X含有38mol电子,还相差22个电子,可考虑含2个Na,即得X为Na
2O
2.Na
2O
2具有强氧化性,可把Fe
2+氧化成Fe
3+,根据题意,向Fe
2+溶液中加入与Fe
2+等物质的量的Na
2O
2固体,恰好完全反应,反应过程可看成Na
2O
2先与水反应,生成的NaOH再与Fe
2+反应,生成Fe(OH)
2,最后Fe(OH)
2再被氧化成Fe(OH)
3,反应方程式为2Na
2O
2+2H
2O═4NaOH+O
2↑、Fe
2++2OH
-═Fe(OH)
2↓、4Fe(OH)
2+O
2+2H
2O═4Fe(OH)
3↓,上述三个反应合并即得总反应方程式为4Fe
2++4Na
2O
2+6H
2O=4Fe(OH)
3+O
2↑+8Na
+.
故答案为:4Fe
2++4Na
2O
2+6H
2O=4Fe(OH)
3+O
2↑+8Na
+.
点评:本题考查元素化合物的推断,解题关键是根据已知信息结合化合物的性质分析、尝试确定各物质,各物质确定后抓住化学性质解决问题.本题涉及知识点较多,难度较大.


 CO2,C+O2(少量)
CO2,C+O2(少量) 2CO,即得B为CO2、D为CO.CO2中碳原子最外层4个电子,氧原子最外层6个电子,碳原子分别与两个氧原子各形成两对共用电子对,即电子式为
2CO,即得B为CO2、D为CO.CO2中碳原子最外层4个电子,氧原子最外层6个电子,碳原子分别与两个氧原子各形成两对共用电子对,即电子式为 ,结构式为O═C═O,键角180°正电荷重心和负电荷重心重合,所以为非极性分子,由电子式可知CO2分子中各原子最外层都满足8电子结构.
,结构式为O═C═O,键角180°正电荷重心和负电荷重心重合,所以为非极性分子,由电子式可知CO2分子中各原子最外层都满足8电子结构. =0.05mol,可见NaOH过量,CO2全部反应掉,
=0.05mol,可见NaOH过量,CO2全部反应掉,

 名校课堂系列答案
名校课堂系列答案 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).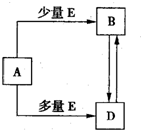 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).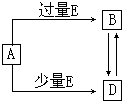 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).