
【题目】向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中
A.c(Ca2+)、c(OH-)均增大B.c(Ca2+)、c(OH-)均保持不变
C.c(Ca2+)、c(OH-)均减小D.c(OH-)增大、c(H+)减小
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述不正确的是
A. 高温下,0.3molFe与足量水蒸气反应,转移电子数目为0.8NA
B. 3.2g由O2和O3组成的混合物中含有的原子数目为0.2NA
C. 在氧化钠与水的反应中,每消耗0.1mol过氧化钠,转移电子的数目为0.1NA
D. 在KClO3+6HCl(浓) ===KCl+3Cl2↑+3H2O反应中,若产生标准状况下6.72LCl2时,转移电子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:
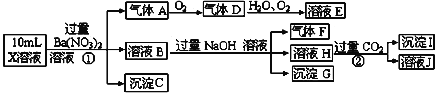
根据以上信息,回答下列问题:
(1)配平①中反应的离子方程式: Fe2+ +H+ +NO3- ===Fe3+ +NO↑+H2O ____
(2)上述离子中,溶液X中除H+外还肯定含有的离子是____,不能确定是否含有的离子是__,若要确定其中阳离子的存在,最可靠的化学方法是____。
(3)沉淀G的化学式为____,写出生成沉淀I的离子方程式____。
(4)假设测定A、F、I均为0.01mol,10ml X溶液中n(H+)=0.04mol,当沉淀C物质的量为0.07mol,能说明(2)中不能确定的阴离子存在的理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF,NO和HNO3 , 请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为 .
(2)写出该反应的化学方程式 . 若反应中生成0.2mol HNO3 , 转移的电子数目为个.
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是 .
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF,H2O外,还肯定有(填化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A(g)B(g)+D(g)在密闭容器中分别在下列四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(molL﹣1)随反应时间(min)的变化情况如下表:
时间 | 1 | 10 | 20 | 30 | 40 | 50 | 60 | |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)实验1中,在10~20min时间内,以A的速率表示的平均反应速率为molL﹣1min﹣1
(2)实验2中,A的初始浓度c2=molL﹣1 , 反应经20min就达到平衡,可推测实验2中还隐含的条件是 .
(3)设实验3的化学反应速率为v3 , 实验1的化学反应速率为v1 , 则v3v1(填“>”“=”或“<”),且c31.0molL﹣1(填“>”“=”或“<”).
(4)比较实验4和实验1,可推测该反应的正反应是反应(填“吸热”或“放热”),理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如图实验可检验某食品中亚硫酸盐含量(所 加试剂均足量). ![]()
下列说法不正确的是( )
A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是
A.氧化物中的氧元素一定呈 - 2价B.酸性氧化物可能是金属氧化物
C.化学键只存在于晶体中D.正四面体分子中键角不可能是600
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 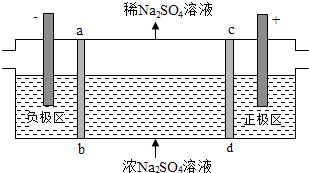
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com