
下列实验方案中,不能测定Na2CO3和NaHCO3,混合物中Na2CO3质量分数的是
| A.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物充分加热,得b克固体 |
| D.取a克混合物与足量Ca(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
向一定量的Fe、FeO、Fe2O3混合物中加入100 mL 1 mol/L盐酸,恰好使混合物完全溶解,放出224 mL(标准状况下)的气体,在所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,可得到铁的质量是( )
| A.11.2g | B.5.6g | C.2.8g | D.无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:2FeCl3+Cu=2FeCl2+CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,不可能出现的结果是
| A.烧杯中有铜无铁 |
| B.烧杯中有铁无铜 |
| C.烧杯中铁、铜都有 |
| D.烧杯中铁、铜都无 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在制作印刷电路板的过程中常利用FeCl3溶液与Cu反应,其反应方程式为:
2FeCl3+Cu 2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
2FeCl2+CuCl2。现向FeCl3溶液中加入a g Cu粉,完全溶解后,再加入b g Fe粉,充分反应后尚有c g残余固体。若c<a,则下列说法正确的是
| A.残余固体全部是Cu |
| B.残余固体可能为Fe和Cu的混合物 |
| C.最后得到的溶液可能含有Fe3+ |
| D.残余固体是Fe,溶液中一定不含Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
碳酸钠(Na2CO3)俗称纯碱,是一种重要的基础化工原料,广泛应用于玻璃、造纸等工业。下列与碳酸钠有关的说法正确的是:
| A.Na2CO3的稳定性介于Na2CO3·10H2O和NaHCO3之间 |
| B.“侯氏制碱法”制得的碱是指NaHCO3 |
| C.可用盐酸鉴别Na2CO3和NaHCO3固体 |
| D.纯碱有时可代替烧碱使用,比如溶解石英、促进乙酸乙酯的水解等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某同学采用下图所示装置进行Fe粉与水蒸气的反应。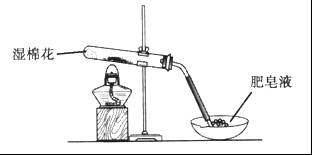
(1)写出Fe粉与水蒸气反应的化学方程式________________。
(2)该同学向反应后的固体中加入过量的稀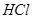 ,并将溶液分装在两支试管中。
,并将溶液分装在两支试管中。
①向第一支试管中滴加KSCN溶液,溶液呈红色,该溶液中存在的阳离子有______。
②向第二支试管中加入适量铁粉。该过程中发生化合反应的离子方程式是________。
再向所得溶液中滴加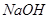 溶液并放置一段时间,该步反应中的实验现象是_________。
溶液并放置一段时间,该步反应中的实验现象是_________。
发生的氧化还原反应的化学方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
硫酸亚铁是一种重要的化工原料,可以制备一系列物质(如图所示)。下列说法错误的是
| A.碱式硫酸铁水解能产生Fe(OH)3胶体,可用作净水剂 |
| B.为防止NH4HCO3分解,生产FeCO3需在较低温度下进行 |
| C.可用KSCN溶液检验(NH4)2Fe(SO4)2是否被氧化 |
| D.常温下,(NH4)2Fe(SO4)2在水中的溶解度比FeSO4的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)某固体可能由Al、(NH4)2SO4、MgCl2、AlCl3、FeCl2中的一种或几种组成,现取该固体进行如下实验,所得现象和有关数据如下所示(气体体积的数据均已折算成标准状况下):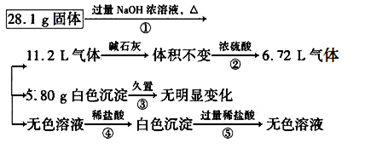
请回答下列问题:
(1)混合物中是否存在FeCl2?________(填“存在”或“不存在”)。
(2)混合物中是否存在(NH4)2SO4?______(填“存在”或“不存在”);你的判断依据是____________。
(3)写出反应④的离子方程式:____________________。
(4)请根据计算判断混合物中是否存在AlCl3:_____(写出你的判断依据,但不必写计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com