
| A. | 闻化学药品的气味时都不能使鼻子凑近药品 | |
| B. | 点燃氢气前要检查纯度,以免发生爆炸 | |
| C. | 在盛O2集气瓶中进行铁丝燃烧实验时,事先在集气瓶底铺上一层沙子 | |
| D. | 凡是给玻璃仪器加热,都要加垫石棉网,以防仪器炸裂 |
分析 A.闻任何化学药品的气味都不能使鼻子凑近药品,避免出现中毒;
B.可燃性气体与空气混合后点燃可能发生爆炸;
C.铁在氧气中燃烧时放出大量的热;
D.给试管加热时,可以直接加热,不需要垫上石棉网.
解答 解:A.闻任何化学药品的气味都不能使鼻子凑近药品,避免出现中毒,正确方法为:用手轻轻在试剂瓶口煽动,让少量的药品气味进入鼻孔,故A正确;
B.可燃性气体与空气混合后点燃可能发生爆炸,氢气具有可燃性,为防止点燃时发生爆炸,点燃前必须要先检验氢气气体的纯度,故B正确;
C.铁丝在氧气中燃烧实验,集气瓶底部要预先放少量的水或铺一层细沙,目的是防止生成物熔化溅落下来炸裂集气瓶,故C正确;
D.在给试管中的药品加热时,不需要垫上石棉网,可以直接给试管加热,故D错误.
故选D.
点评 本题考查常见仪器的使用和化学基本操作的方法,题目难度不大,注意在学习中加强基础知识的积累.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:选择题
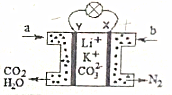 某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH3OH为燃料时,该电池工作原理如图.下列说法正确的是( )
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH3OH为燃料时,该电池工作原理如图.下列说法正确的是( )| A. | b为空气,电子由X极经导线流向Y极 | |
| B. | 在熔融电解质中,CO32-向X极移动 | |
| C. | 消耗1molCH3OH,消耗氧气分子数目约为3×6.02×1023 | |
| D. | 正极反应式为:O2+2CO2+4e-═2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的燃烧热为 297.2 kJ/mol | |
| B. | S(g)+O2(g)=SO2(g)放出的热量大于297.2 kJ | |
| C. | S(g)+O2(g)=SO2(g)放出的热量小于297.2 kJ | |
| D. | 形成1 mol SO 2中的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)中的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
| 浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
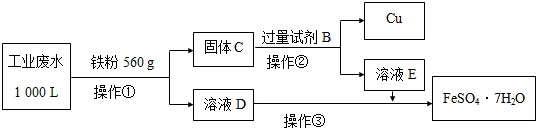
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
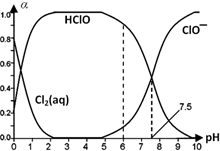 Cl2及其化合物在生产、生活中有广泛用途,回答下列问题.
Cl2及其化合物在生产、生活中有广泛用途,回答下列问题. HClO+H++Cl-或Cl2(aq)+H2O
HClO+H++Cl-或Cl2(aq)+H2O HClO+HCl、HClO
HClO+HCl、HClO H++ClO-.
H++ClO-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤时用玻璃棒搅拌漏斗里的液体 | |
| B. | 加热后的蒸发皿用坩埚钳夹取 | |
| C. | 用自来水制蒸馏水实验中,将温度计水银球插到蒸烧瓶自来水中 | |
| D. | 从碘水中提取单质碘时,可用无水乙醇代替CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱可用于治疗胃酸过多的药剂 | |
| B. | 铝制容器可用于常温下贮存、运输浓硫酸 | |
| C. | 二氧化硅可用于制造光导纤维和石英坩埚 | |
| D. | 过氧化钠可用作漂白剂和呼吸面具中的供氧剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com