
【题目】2016年诺贝尔化学奖由三位化学家共同获得,以表彰他们在研究纳米分子机器中的“马达分子”取得的成就,“马达分子”的关键组件是三蝶烯(图1),下列说法正确的是
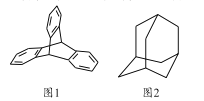
A. 三蝶烯的分子式为C20H16 B. 三蝶烯属于苯的同系物
C. 金刚烷(图2)属于饱和烃 D. 三蝶烯和金刚烷的一氯代物均只有一种
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8 kJ·mol-1
B.图2表示压强对可逆反应2A(g)+2 B(g)![]() 3C(g)+D(s)的影响,乙的压强比甲的压强大
3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图4表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同条件下NaA溶液的pH大于同浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废气中的含氮氧化物是主要的大气污染物,因此脱出废气中的含氮氧化物对于保护大气环境具有重要的意义。
(1)汽车的大量使用是城市大气中含氮氧化物的主要来源。
①汽车燃油中一般不含有氮元素,汽车尾气中的NO是如何产生的?___________(用化学方程式表示)。
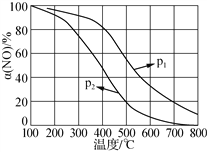
②NO易被O2氧化为NO2。其他条件不变时,NO的氧化率[α(NO)%]与温度、压强的关系如图所示。则p1________p2(填“>”、“<”或“=”);温度高于800℃时,α(NO)几乎为0的原因是_____。
(2)利用氨气脱除NO是大气污染防治研究的热点,过程中涉及的反应为:
主反应:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g)
4N2(g)+6H2O(g)
副反应:
①4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-905.5kJ/mol
4NO(g)+6H2O(g) ΔH=-905.5kJ/mol
②4NH3(g)+4O2(g)![]() 2N2O(g)+6H2O(g) ΔH=-1104.9kJ/mol
2N2O(g)+6H2O(g) ΔH=-1104.9kJ/mol
③4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=-1269.0kJ/mol
2N2(g)+6H2O(g) ΔH=-1269.0kJ/mol
回答下列问题:
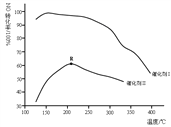
主反应的ΔH为____________________;保持其它条件相同,使用两种不同的催化剂,主反应NO的转化率与温度关系如图所示,选用催化剂I的优势有_________________(写出一点即可);R点对应的温度为210℃,低于210℃,NO的转化率是不是对应温度下的平衡转化率,请作出判断并写出理由__________________。
(3)碱液吸收法:用Na2CO3溶液吸收NO2生成CO2.若每4.6gNO2和Na2CO3溶液反应时转移电子数为0.05mol,则反应的离子方程式是__________。
(4)常温下,在通入O2的条件下用0.1mol/L的NaOH溶液吸收NO,产物为NaNO3 和NaNO2。已知反应后溶液的pH=12,溶液中NO2-浓度为5.6×10-2mol/L(忽略反应过程中溶液体积变化,HNO2的电离平衡常数Ka=5.1×10-4),则:
①![]() =________mol/L
=________mol/L
②反应后溶液中NO3-的浓度约为___________mol/L
③某溶液中c(NO2-)=1.0×10-6mol/L,取该溶液5mL,加入一滴0.1mol/L硝酸银溶液(一滴为0.05mL),通过计算说明能否产生沉淀______________。(Ksp(AgNO2)=2×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】油脂的组成可用“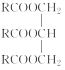 ”来表示,其中R为碳原子数目多于10的链烃基,可以相同也可以不同。分子式为C51H92O6的某油脂在稀硫酸中加热水解后得到A、B两种物质,若A的相对分子质量为92(已知:R1—CH=CH—R2
”来表示,其中R为碳原子数目多于10的链烃基,可以相同也可以不同。分子式为C51H92O6的某油脂在稀硫酸中加热水解后得到A、B两种物质,若A的相对分子质量为92(已知:R1—CH=CH—R2![]() R1—COOH+R2—COOH),则:
R1—COOH+R2—COOH),则:
(1)B的分子式为________,A的结构简式为________。
(2)B![]() C+D,等物质的量的C、D分别与足量的NaOH溶液反应时,消耗的NaOH的质量之比为1∶2,C、D的相对分子质量相差30且C、D结构中均无支链,则B的结构简式为________。
C+D,等物质的量的C、D分别与足量的NaOH溶液反应时,消耗的NaOH的质量之比为1∶2,C、D的相对分子质量相差30且C、D结构中均无支链,则B的结构简式为________。
(3)若A和乙酸在一定条件下反应后生成相对分子质量为134的E,写出E所有可能的结构简:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为短周期元素①~⑧的部分性质,下列说法正确的是
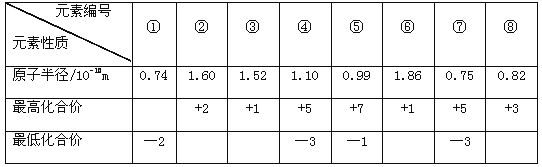
A. 元素⑦的气态氢化物稳定性比元素④的气态氢化物稳定性强
B. 元素④的最高价氧化物对应水化物的酸性比元素⑤的最高价氧化物对应水化物的酸性强
C. 元素①⑧形成的化合物具有两性
D. 上表8种元素中,元素③的最高价氧化物对应水化物的碱性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列方程式
(1)制溴苯__________________________________________________
(2)制TNT__________________________________________________
(3)由乙炔制聚氯乙烯_______________________________________________________________________________________________________
(4)60℃时1,3—丁二烯与溴水的1,4—加成反应
___________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠电池由于其快速充放电的特性受到科研工作者的重视,某钠离子钛基电池电池结构如图所示,电解质为含钠离子的高聚物,已知电池的反应方程式为2NaxCn+xNaTi2(PO4)3![]() 2nC+ xNa3Ti2(PO4)3。下列关于该电池说法正确的是
2nC+ xNa3Ti2(PO4)3。下列关于该电池说法正确的是

A. 放电时电池正极为NaxCn B. 放电时Na+向电极Ⅱ移动
C. 充电时阳极反应:NaxCn-xe-=nC+xNa+ D. 充电时电极Ⅰ与外电源正极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:___________。
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银.
①(H3PO2)中,磷元素的化合价为___________。
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:___________(填化学式);
③NaH2PO2是 正盐还是酸式盐?___________,其溶液显___________性(填“弱酸性”、“中性”、或者“弱碱性”)。
(3)H3PO2的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式___________。
(4)(H3PO2)也可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式___________;
②分析产品室可得到H3PO2的原因___________;
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是___________杂质。该杂质产生的原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com