
| A. | 可用稀盐酸除去铜器表面的铜绿 | |
| B. | 硫酸铜溶液可用作游泳池的消毒剂 | |
| C. | 工业上常采用电解法制取粗铜 | |
| D. | 在上述几种含铜化合物中,铜的质量百分含量最高的是Cu2S |
分析 A.铜绿的主要成分为Cu2(OH)2CO3,能与稀盐酸反应;
B.重金属能使蛋白质变性,硫酸铜作消毒剂是利用重金属盐的性质;
C.工业上常用热还原法制取粗铜,然后通过电解的方法制取精铜;
D.铜化合物中,铜的质量百分含量=$\frac{铜的原子量×原子个数}{式量}$,据此计算比较这几种含铜化合物的化学式可知Cu2S中铜的质量分数最高.
解答 解:A.铜绿与盐酸反应:Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑,氯化铜易溶于水,所以可用稀盐酸除去铜器表面的铜绿,故A正确;
B.硫酸铜属于重金属盐,能使蛋白质变性,故可用作游泳池的消毒剂,故B正确;
C.冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用热还原法,铜处于金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来,如CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,故C错误;
D.铜化合物中,铜的质量百分含量=$\frac{铜的原子量×原子个数}{式量}$,黄铜矿中铜的含量=$\frac{64}{64+56+32×2}$=35%;斑铜矿中铜的含量=$\frac{64×5}{64×5+56+32×4}$=63%;辉铜矿中铜的含量=$\frac{64×2}{64×2+32}$=80%;孔雀石中铜的含量=$\frac{64×2}{64×2+12+16×5+1×2}$=58%所以铜的质量百分含量最高的是Cu2S,故D正确;
故选C.
点评 本题考查常见的铜矿石,掌握铜及其化合物的性质是解答关键,注意工业上常用热还原法制取粗铜,然后通过电解的方法制取精铜,不是采用电解法制取粗铜,为易错点,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 保持容器的体积不变充入1molHe | ||
| C. | 将水蒸气从体系中分离出 | D. | 增大容器容积,减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
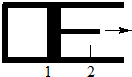 一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g).达平衡后,测得A的浓度为0.5mol•L-1.恒温下将活塞由1处拉到2处,再次达到平衡后,测得A的浓度为0.225mol•L-1.则下列说法中,正确的是( )
一定量混合气体在密闭容器中发生如下反应:xA(g)+yB(g)?zC(g).达平衡后,测得A的浓度为0.5mol•L-1.恒温下将活塞由1处拉到2处,再次达到平衡后,测得A的浓度为0.225mol•L-1.则下列说法中,正确的是( )| A. | x+y<z | B. | 平衡向逆反应方向移动 | ||
| C. | B的转化率减小 | D. | C的体积分数降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | 安装燃煤“固硫”装置,可以降低酸雨发生率 | |
| C. | 棉花的主要成分是纤维素,石英玻璃、陶瓷和水泥均属于硅酸盐产品 | |
| D. | 铜制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH2OH和HCl | B. | NH3•H2O和HCl | C. | NH3和HClO3 | D. | NH3和HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl(Na2CO3) | B. | Fe(Cu) | C. | Na2CO3(CaCO3) | D. | HCl(BaCl2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com