
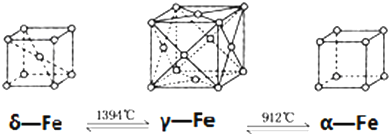
| A. | δ、γ、α三种晶体互为同分异形体 | |
| B. | α-Fe晶体中与每个铁原子等距离且最近的铁原子有6个 | |
| C. | 将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体类型不同,化学性质相同 | |
| D. | γ-Fe晶体为面心立方密堆积 |
分析 A.Fe的δ、γ、α三种晶体属于同素异形体;
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子是相邻顶点上铁原子;
C.晶体类型不同,结构不同,物理性质不同,但化学性质相同;
D.γ-Fe晶体中Fe原子处于顶点与面心,属于面心立方密堆积.
解答 解:A.Fe的δ、γ、α三种晶体结构不同,属于同素异形体,不是同分异构体,故A错误;
B.α-Fe晶体中与每个铁原子距离相等且最近的铁原子是相邻顶点上铁原子,与每个铁原子等距离且最近的铁原子有2×3=6各,故B正确;
C.急速冷却和缓慢冷却,得到的晶体类型不同,结构不同,物理性质不同,但化学性质相同,故C正确;
D.γ-Fe晶体中Fe原子处于顶点与面心,属于面心立方密堆积,故D正确,
故选:A.
点评 本题考查晶胞的结构、同素异形体与同分异构体的概念等知识,难度不大,注重基础知识的理解掌握.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
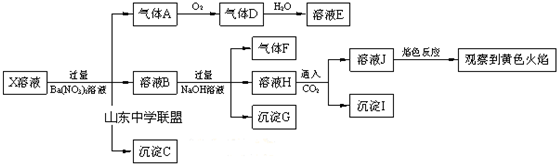
| A. | X中肯定存在Na+、Fe2+、A13+、NH4+、SO42- | |
| B. | 气体F在氧气中经催化氧化可生成气体A | |
| C. | 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3、沉淀I一定是Al(OH )3 | |
| D. | X中不能确定的离子是Fe2+、SO32-、K+和C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | 物质A的转化率增大 | ||
| C. | 物质B的质量分数增加 | D. | a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
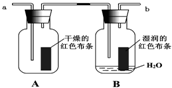 为了探究“红色布条褪色的原因与次氯酸有关而跟氯气无关”.某学生设计了如图装置进行实验.请回答:
为了探究“红色布条褪色的原因与次氯酸有关而跟氯气无关”.某学生设计了如图装置进行实验.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自来水生产中应尽量用氯气消毒 | |
| B. | 充分利用地沟油提炼食用油,提高原料利用率 | |
| C. | 添加硫酸铁制“铁强化酱油”,添加碘酸钾制加碘盐 | |
| D. | 高纯硅及其氧化物在太阳能电池及信息高速传输中有重要应用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com