
工业上从铝土矿(主要成分是Al2O3,还含有SiO2、Fe2O3等杂质)中提取铝可选用如下工艺流程:
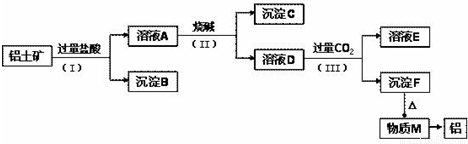
已知:SiO2不溶于水且不与盐酸反应。
请回答下列问题:
(1)图中涉及分离溶液与沉淀的实验方法是______(填操作名称)。
(2)步骤(Ⅱ)中加入的烧碱溶液应该是______(填“少量”或“过量”)。沉淀B的成分是______(填化学式,下同);溶液D中含铝元素的溶质的是______。
(3)①物质M在生产生活中有重要用途,写出沉淀F转化为物质M的化学方程式:______;
②溶液D中通入______CO2生成沉淀F的离子方程式为:______.
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江苏省淮安市高一上学期期末调研测试化学试卷(解析版) 题型:填空题
填空:
(1)0. 5 mol NH3分子中所含氮原子数为__________个;
(2)1.2g RSO4中含0.01 mol R2+,则RSO4的摩尔质量是__________;
(3)0.1 mol·L-1的 Cu(NO3)2溶液中NO3-的物质的量浓度是__________;
(4)新制氯水在阳光照射下产生的无色气体是__________;
(5)配制100 mL 1 mol/L NaCl溶液,定容后,把容量瓶倒置摇匀后发现液面低于刻度线,补加水至刻度处,会引起所配溶液物质的量浓度__________(选填“偏高、偏低、无影响”);
(6)实验室制备氯气时,收集氯气常采用__________法。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省菏泽市高一上学期期末考试(B卷)化学试卷(解析版) 题型:选择题
铜粉放入稀硫酸溶液中,加热后无明显现象发生。当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出。该盐是( )
A. Fe2(SO4)3 B. KNO3 C. FeSO4 D. Na2CO3
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期二调考试理综化学试卷(解析版) 题型:填空题
A、B、C、D、E、F均为周期表中前四周期的元素。请按要求回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:

下列有关A、B的叙述不正确的是(____)a.离子半径A<B b.电负性A<B
c.单质的熔点A>B d.A、B的单质均能与氧化物发生置换
e.A的氧化物具有两性 f.A、B均能与氯元素构成离子晶体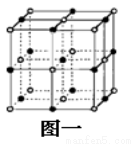
(2)C是地壳中含量最高的元素,C基态原子的电子排布式为_______。Cn-比D2+少l个电子层。二者构成的晶体的结构与NaCl晶体结构相似(如图一所示),晶体中一个D2+周围和它最邻近且等距离的D2+有_____个。
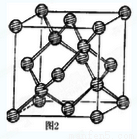
(3)E元素原子的最外层电子数是其次外层电子数的2倍,则乙酸分子中E原子的杂化方式有_____。E的一种单质其有空间网状结构,晶胞结构如图2。己知位于晶胞内部的4个原子,均位于体对角线的1/4或3/4处,E-E键长为apm,则E晶体的密度为_________g/cm3(用含有NA、a的式子表示)。
(4)F与硒元素同周期,F位于p区中未成对电子最多的元素族中,F的价电子排布图为
______,FO33-离子的空间构型为__________;F第一电离能_______硒元素(填“>”或“<”)
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三下学期二调考试理综化学试卷(解析版) 题型:选择题
下列有关说法错误的是( )
A. 油脂的种类很多,但它们水解后都一定有一产物相同
B. 淀粉、纤维素都属糖类,它们通式相同,但它们不互为同分异构体
C. 已知CH4+H2O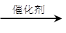 CH3OH+H2,该反应的有机产物是无毒物质
CH3OH+H2,该反应的有机产物是无毒物质
D. C(CH3)4的二氯代物只有2种
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
以下配制溶液叙述正确的是( )
A. 配制一定物质的量浓度溶液时,若加水超容量瓶刻度应用胶头滴管将多余溶液吸出
B. 用容量瓶配制溶液,定容时俯视读数,所配溶液浓度偏大
C. 欲配制1L1.0mol/L的NaCl溶液,可将58.5gNaCl溶于IL水中
D. 稀释后的H2SO4未等冷却至室温可立即转移到容最瓶中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省南昌市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是( )
A. 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
B. 稀H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑
C. AlCl3溶液中加入足量的氨水:Al3++3OH-=Al(OH)3↓
D. 将氢氧化铁放入盐酸中: Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源:广东省2016-2017学年高二上学期期末考试化学(文)试卷 题型:选择题
既能与酸又能与碱反应是两性化合物的特征。下列物质属于两性化合物的是
A. A1 B. Na2CO3 C. A1(OH)3 D. (NH4)2SO4
查看答案和解析>>
科目:高中化学 来源:2017届浙江省温州市高三第二次选考模拟考试(2月)化学试卷(解析版) 题型:实验题
【加试题】乳酸亚铁:{[CH3CH(OH)COO]2Fe·3H2O,M=288.0g/mol}是一中新型的优良补铁剂,绿白色晶体,溶于水,几乎不溶于乙醇。某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成乳酸亚铁。
已知:
①几种金属离子生成氢氧化物沉淀的PH(开始沉淀的PH按金属离子浓度为1.0mol/L计算)。
金属离子 | 开始沉淀的PH | 沉淀完全的PH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
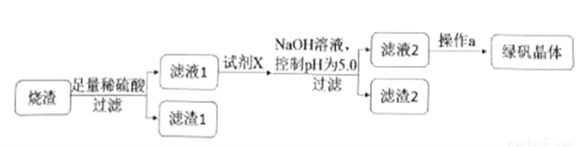
②研究性学习小组设计的由烧渣制备绿矾晶体的操作流程如下:
③由绿矾(FeSO4·7H2O)制备乳酸亚铁涉及下列反应:
FeSO4+Na2CO3=FeCO3↓+Na2SO4
2CH3CH(OH)COOH+FeCO3+2H2O [CH3CH(OH)COO]2Fe·3H2O+CO2↑。
[CH3CH(OH)COO]2Fe·3H2O+CO2↑。
请回答:
(1)滤渣2的成分为__________(写化学式)。
(2)操作a为蒸发浓缩、冷却结晶、抽滤、洗涤、干燥。洗涤绿矾粗产品的具体操作为_______。
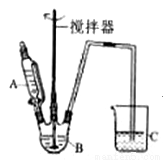
(3)据题干信息,欲制备较纯净的FeCO3时,某同学设计的实验装置示意图如图所示(夹持装置省略)。仪器A 中存放的试剂为________,装置C的作用为___________。
(4)在室温下,将所得的乳酸亚铁成品用无水乙醇进行浸泡2次,从而得到精制产品。选择用无水乙醇进行浸泡的优点是___________(写出两点)。
(5)该学习小组同学用KMnO4滴定法测定样品中Fe2+的量进而计算产品中乳酸亚铁的纯度,发现结果总是大于100%,其原因可能是___________。
经查阅文献后,小组同学改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取0.576g样品,溶解后进行必要处理,用0.1000mol/L Ce(SO4)2标准溶液滴定至终点,记录数据如下表。
滴定次数 | 0.1000mol/L Ce(SO4)2标准溶液体积/mL | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 19.85 |
2 | 0.12 | 21.32 |
3 | 1.05 | 20.70 |
则产品中乳酸亚铁的纯度为________(以质量分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com