
| A. | H+,Cu2+,Fe3+、SO4 2- | B. | Ba2+,Na+,Al3+、Cl- | ||
| C. | K+、Ag+ NH4+,NO3- | D. | Na+、K+、Br-、OH- |
分析 A.通入氨气后,氢离子、铁离子和铜离子都与氨气反应;
B.四种离子之间不反应,但铝离子与一水合氨反应生成氢氧化铝沉淀;
C.Ag+在溶液中与氨气反应;
D.四种离子之间不发生反应,通入氨气后也不反应.
解答 解:A.H+、Cu2+、Fe3+、SO4 2-都与一水合氨反应,在溶液中不能大量共存,故A错误;
B.Fe3+与一水合氨反应生成沉淀,在溶液中不能大量共存,故B错误;
C.通入氨气后,Ag+与一水合氨反应,在溶液中不能大量共存,故C错误;
D.Na+、K+、Br-、OH-之间不反应,通入氨气后也不反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:通入氨气后,溶液中存在大量氢氧根离子,能够与氢氧根离子反应的离子不能共存.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3-CH2-CH2-CH3与 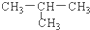 | B. | C3H8与C6H14 | ||
| C. | 乙烯和1,3-丁二烯 | D. | CH3CH2Cl 和CH2ClCH2CH2Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通CO的一极是电池的正极 | |
| B. | 该电池工作过程中需不断补充CO和O2,CO2可循环利用 | |
| C. | 负极反应式为:O2+2CO2+4e-→2CO32- | |
| D. | 正极反应式为:2CO+2CO32-→4CO2+4e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅦA族元素是同周期中非金属性最强的元素 | |
| B. | 原子序数为15的元素的最高化合价为+3 | |
| C. | 最外层电子数是2的元素一定位于元素周期表的第ⅡA族 | |
| D. | 第二周期ⅣA族元素的原子核电荷数和中子数一定为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径是第ⅡA族中最大的 | B. | 遇冷水能剧烈反应 | ||
| C. | 位于第七周期 | D. | Ra(OH)2是两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:Na+、K+、AlO2-、CO32- | |
| B. | 含有大量Fe3+的溶液中:NH4+、SCN-、Cl-、K+ | |
| C. | pH=7的溶液中:NH4+、Al3+、SO42-、CO32- | |
| D. | c(OH-)=1×10-13 mol/L的溶液中:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )
如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开K2,闭合K1一段时间,观察到两支玻璃管内都有气泡将电极包围,此时断开K1,闭合K2,观察到电流计A的指针有偏转.下列说法不正确的是( )| A. | 断开K2,闭合K1一段时间,溶液的pH变大 | |
| B. | 断开K1,闭合K2时,b极上的电极反应式为:2H++2e-═H2↑ | |
| C. | 断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑+2H2O | |
| D. | 断开K1,闭合K2时,OH-向b极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKp | 37.4 | 19.3 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com