
| A、在标准状况下,2.24 L HF含有的电子数为NA |
| B、7.8 g Na2S和Na2O2的混合物中所含离子数为0.3NA |
| C、常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
| D、电解精炼铜时,阳极质量每减少32 g,电路中就转移NA个电子 |


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
| △ |


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、光导纤维和陶瓷都是硅酸盐产品 |
| B、晶体硅可用于制造芯片 |
| C、钢铁厂用热还原法冶炼铁 |
| D、焙制糕点的发酵粉主要成分之一是碳酸氢钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
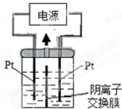
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)=2H2O (l)△H=-285.8 kJ?mol-1 |
| B、2H2(g)+O2(g)=2H2O (l)△H=+571.6 kJ?mol-1 |
| C、2H2(g)+O2(g)=2H2O (g)△H=-571.6 kJ?mol-1 |
| D、H2(g)+1/2O2(g)=H2O (l)△H=-285.8 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ①443-573K |
| 熔烧 |
| ②进一步加热 |
| 到773-873K |
| 通入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、n(盐酸)<n(稀硝酸)<n(烧碱) |
| B、n(烧碱)<n(盐酸)<n(稀硝酸) |
| C、n(烧碱)<n(稀硝酸)<n(盐酸) |
| D、n(稀硝酸)<n(烧碱)<n(盐酸) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图所示.下列说法正确的是( )
甲、乙是两种氮的氧化物且所含元素价态均相同,某温度下相互转化时的量变关系如图所示.下列说法正确的是( )| A、甲是N2O4 |
| B、a点处于平衡状态 |
| C、t1~t2时间内v正(乙)<v逆(甲) |
| D、反应进行到t2时刻,改变的条件可能是升高温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com