有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的一种单质硬度很大,C燃烧时使火焰呈现黄色,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物E,试根据以上叙述回答:
(1)元素名称:A B C D
(2)E与A的最高价氧化物反应的方程式为
(3)D在周期表中的位置 ,
(4)9克A单质充分燃烧后的产物通入1L 1mol/LNaOH溶液中,所得溶液的溶质及其物质的量为 .
(5)写出D的最高价氧化物的水化物和A反应的化学方程式:
.
【答案】
分析:C燃烧时使火焰呈现黄色.则C为Na;C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物E,则B为O、E为Na
2O
2、D为S;A和B原子有相同的电子层数,且A的一种单质硬度很大,则A为C
解答:解:(1)C燃烧时使火焰呈现黄色.则C为Na;C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物E,则B为O、E为Na
2O
2、D为S;A和B原子有相同的电子层数,且A的一种单质硬度很大,则A为C.
故答案为:碳,氧,钠,硫;
(2)过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2Na
2O
2+2CO
2=2Na
2CO
3+O
2↑,
故答案为:2Na
2O
2+2CO
2=2Na
2CO
3+O
2↑;
(3)硫元素在第三周期,ⅥA主族,故答案为:第三周期 第VIA族;
(4)9g碳完全燃烧生成0.75mol二氧化碳,通入含1mol氢氧化钠的溶液中,0.5molCO
2与NaOH反应生成0.5molNa
2CO
3,剩余0.25molCO
2与0.25molNa
2CO
3反应生成0.5molNaHCO
3,故答案为:0.25molNa
2CO
3 0.5molNaHCO
3;
(5)D的最高价氧化物的水化物是硫酸,浓硫酸与碳反应生成二氧化碳、二氧化硫和水,
反应的化学方程式为C+2H
2SO
4(浓)
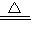
CO
2↑+2SO
2↑+2H
2O,
故答案为:C+2H
2SO
4(浓)

CO
2↑+2SO
2↑+2H
2O.
点评:本题主要考查元素推断及元素化合物性质,难度不大.

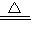 CO2↑+2SO2↑+2H2O,
CO2↑+2SO2↑+2H2O, CO2↑+2SO2↑+2H2O.
CO2↑+2SO2↑+2H2O.










