
 短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示.请回答下列问题:
短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示.请回答下列问题:
| ||
| ||
| ||
| ||


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
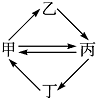 下列各组物质按如图所示转化关系每一步都能一步实现的是( )
下列各组物质按如图所示转化关系每一步都能一步实现的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | FeCl3 | FeCl2 | Fe2O3 | Fe(OH)3 |
| B | Cu | CuO | CuSO4 | CuCl2 |
| C | SO2 | H2SO4 | SO3 | H2S |
| D | Al(OH)3 | NaAlO2 | Al2O3 | AlCl3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
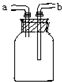
| A、洗气或干燥装置:瓶内放一定体积溶液,由a进气 |
| B、用于收集不溶于水的气体:瓶内充满水,由a进气 |
| C、提供少量CO:瓶内充满CO,a接自来水龙头 |
| D、病人输氧时用于观察输氧速度:瓶内装适量水,b接病人鼻腔 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用25ml量筒量取12.3ml盐酸;用托盘天平称取8.75g食盐 |
| B、用pH试纸测得某氯水的pH为2;用标准NaOH溶液滴定未知浓度的盐酸,用去NaOH溶液23.10ml |
| C、将质量分数为5%和25%的氨水等体积混合后,所得溶液中溶质的质量分数大于15% |
| D、浓硝酸必须保存在棕色玻璃瓶中;钠必须保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、固态溴化碘是由极性键构成的分子晶体 |
| B、和NaOH溶液反应生成NaCl和NaBrO |
| C、能使湿润的淀粉碘化钾试纸变蓝 |
| D、与水反应时BrCl既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0 的溶液不存在 |
| B、中性溶液的c(H+)不一定等于10-7 |
| C、溶液稀释时,pH值减小 |
| D、用湿润的pH试纸测定某溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出C6H6的一种含叁键且无双键、无支链的链烃的结构简式
(1)由于苯的含碳量与乙炔相同,人们认为它是一种不饱和烃,写出C6H6的一种含叁键且无双键、无支链的链烃的结构简式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com