
A、 |
B、 |
C、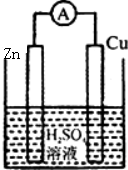 |
D、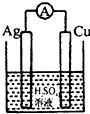 |


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
 Ⅰ.依据氧化还原反应:2Ag+(aq)+Cu (s)=Cu2+(aq)+2Ag(s) 设计的原电池如图所示.请回答:
Ⅰ.依据氧化还原反应:2Ag+(aq)+Cu (s)=Cu2+(aq)+2Ag(s) 设计的原电池如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同浓度的Na2SO4和Na2CO3混合溶液中滴加BaCl2溶液,BaSO4先析出 | ||||||||
| B、BaCO3的悬浊液中加入少量的新制氯水,c(Ba2+)增大 | ||||||||
C、BaSO4和BaCO3共存的悬浊液中
| ||||||||
| D、BaSO4悬浊液中加入Na2CO3浓溶液,BaSO4不可能转化为BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3O4溶于稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B、铝片溶于NaOH溶液:Al+2OH-=AlO2-+H2↑ |
| C、向苯酚钠溶液中通入少量CO2;C6H5O-+CO2+H2O→C6H5OH+HCO3- |
| D、向含1mol碘化亚铁的溶液中通入标准状况下22.4L氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种难溶电解质作比较时,Ksp越小溶解度越小 |
| B、欲使溶液中某离子沉淀完全,加入的沉淀剂越多越好 |
| C、所谓沉淀完全就是用沉淀剂将溶液中某一离子除净 |
| D、温度一定时,当溶液中Ag+和Cl-浓度的乘积等于Ksp时,此溶液为AgCl的饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③ | B、③⑥ | C、①④ | D、⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、M<N | B、M>N |
| C、M=N | D、无法比较 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的一元酸和pH=11的一元强碱等体积混合后的溶液中:c(OH-)=c(H+) |
| B、在0.1 mol?L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C、已知叠氮酸(HN3)与醋酸酸性相近,则在NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(OH?)>c(N3?)>c(H+) |
| D、0.2 mol?L-1NaHCO3溶液中加入等体积0.1 mol?L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 合成氨工业的出现大大缓解了人类粮食危机,合成氨工业的核心反应是:N2+3H2
合成氨工业的出现大大缓解了人类粮食危机,合成氨工业的核心反应是:N2+3H2 | 催化剂 |
| 高温高压 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com