
氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示:
(1)该流程中可以循环的物质是 。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式 ,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果 。
(3)右图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是 ,E电极的名称是 。电解总反应的离子方程式为 。
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为 。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为 。
(1)氯化钠 氢氧化钠
(2)Ca2++ CO32- = CaCO3↓ Mg2+ + 2OH- = Mg(OH)2↓ 用试剂处理后的盐水中还含有少量Mg2+、Ca2+,碱性条件下会生成沉淀,损害离子交换膜。
(3)H2 阳极 2Cl-+2H2O Cl2↑+H2↑+2 OH-
Cl2↑+H2↑+2 OH-
(4)Na2SO3 + Cl2 + H2O = Na2SO4 + 2HCl
(5)93.46%
解析试题分析:氯碱工业的电解原理是2Cl-+2H2O Cl2↑+H2↑+2OH-。(1)从图上看未电解的NaCl和产物NaOH可以循环使用。(2)粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,一次精制时加入纯碱和烧碱,其中CO32-使Ca2+沉淀,OH-使Mg2+沉淀;用试剂处理后的盐水中还含有少量Mg2+、Ca2+,若食盐水不经过二次精制就直接进入离子膜电解槽,碱性条件下会生成沉淀,损害离子交换膜。
Cl2↑+H2↑+2OH-。(1)从图上看未电解的NaCl和产物NaOH可以循环使用。(2)粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,一次精制时加入纯碱和烧碱,其中CO32-使Ca2+沉淀,OH-使Mg2+沉淀;用试剂处理后的盐水中还含有少量Mg2+、Ca2+,若食盐水不经过二次精制就直接进入离子膜电解槽,碱性条件下会生成沉淀,损害离子交换膜。
(3)图中Na+由左侧通过离子交换膜进入右侧,说明F电极为H+放电,是阴极,B处产生的气体是H2;
E电极是阳极。电解总反应的离子方程式即电解原理。
(4)溶解氯与亚硫酸钠溶液反应,Cl2变成Cl-,亚硫酸钠变成硫酸钠,注意水参与了反应。
(5)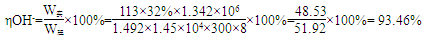
考点:氯碱工业的物质转化流程和电解原理的应用。


科目:高中化学 来源: 题型:填空题
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病,KI、KIO3曾先后用于加碘盐中。
(1)工业上可以通过铁屑法生产KI,其工艺流程如下:
①反应I生成铁与碘的化合物,若该化合物中铁元素与碘元素的质量比为21:127,则加入足量碳酸钾时,反应Ⅱ的化学方程式为 。
②操作A包括 ;用冰水洗涤的目的是 。
(2)KIO3可以通过H2O2氧化I2先制得HIO3,然后再用KOH中和的方法进行生产。
①烹饪时,含KIO3的食盐常在出锅前加入,其原因是 。
②若制得1284 kg KIO3固体,理论上至少需消耗质量分数为30%的双氧水 kg。
③KIO3还可通过下图所示原理进行制备。电解时总反应的离子方程式为 。若忽略溶液体积的变化,则电解结束后阴极区的pH与电解前相比 (选填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电化学原理在工业生产中有着重要的作用,请利用所学知识回答有关问题。
(1)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。如是电解产生多硫化物的实验装置:
①已知阳极的反应为(x+1)S2-=Sx+S2-+2xe-,则阴极的电极反应式是____________________________
当反应转移x mol电子时,产生的气体体积为____________(标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示):___________________________。
(2)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为______________________。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为_______________________,
当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为________,MnO2的理论产量为________g。
(3)用图电解装置可制得具有净水作用的 。实验过程中,两极均有气体产生,Y极区溶液逐渐生成
。实验过程中,两极均有气体产生,Y极区溶液逐渐生成

①电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。
②电解过程中,Y极发生的电极反应为Fe-6e-+8OH-= +4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
+4H2O和______________________________,若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图所示,在不同的电解质溶液中可以组成不同的电池。
(1)①当电解质溶液为稀硫酸时,Fe电极是 (填“正”或“负”)极,其电极反应式为
。
②当电解质溶液为NaOH溶液时,Al电极是 (填“正”或“负”)极,其电极反应式为 。
(2)若把铝改为锌,电解质溶液为浓硝酸,则Fe电极是 (填“正”或“负”)极,其电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为相互串联的甲乙两个电解池,X、Y为直流电源的两个电极。电解过程中,发 现石墨电极附近先变红。请回答:
(1)电源X极为 极(填“正”或“负”),乙池中Pt电极上的电极反应式为 。
(2)甲池若为电解精炼铜的装置,其阴极增重12.8 g,则乙池中阴极上放出的气体在标准状况下的体积为 ,电路中通过的电子为 mol。
(3)在(2)的情况下,若乙池剩余溶液的体积仍为400 mL,则电解后所得溶液c(OH-)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
市场上出售的“热敷袋”的主要成分为铁屑、炭粉、木屑、少量氯化钠和水等。“热敷袋”启用之前用塑料袋使其与空气隔绝,启用时,打开塑料袋轻轻揉搓就会放出热量。使用完后,会发现有大量铁锈存在。
(1)“热敷袋”放出的热量是利用铁发生了 反应放出热量。
(2)炭粉的主要作用是 。
(3)加入氯化钠的主要作用是 。
(4)木屑的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某原电池装置中盛有浓KOH溶液,若分别向__________(填“正”或“负”,下同)极通入可燃性气体,向__________极通入O2,则电路中就有电流通过,电流方向由__________极流向__________极,溶液中OH-向__________极移动。试完成下列问题:
| | 可燃性气体 | 正极反应 | 负极反应 | 电池总反应 | pH变化 |
| (1) | H2 | | | | |
| (2) | CO | | | | |
| (3) | CH4 | | | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氢气是未来最理想的能源,科学家最近研制出利用太阳能产生激光,并在二氧化钛(TiO2)表面作用使海水分解得到氢气的新技术:2H2O  2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
2H2↑+O2↑。制得的氢气可用于燃料电池。试回答下列问题:
(1)分解海水时,________能转变为________能,二氧化钛作________。生成的氢气用于燃料电池时,________能转变为________能。水分解时,断裂的化学键为________键,分解海水的反应属于________反应(填“放热”或“吸热”)。
(2)某种氢氧燃料电池是用固体金属氧化物陶瓷作电解质,两极上发生的电极反应如下:
A极:2H2+2O2--4e-=2H2O
B极:O2+4e-=2O2-
则A极是电池的________极;电子从该极________(填“流入”或“流出”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图所示的实验(图中所用电极均为惰性电极):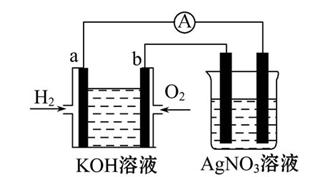
(1)对于氢氧燃料电池,下列表达不正确的是 。
| A.a电极是负极,OH-移向负极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com