
【题目】下列说法正确的是( )。
A. 根据反应Cu+H2SO4![]() CuSO4+H2↑可推知Cu的还原性比H2的强
CuSO4+H2↑可推知Cu的还原性比H2的强
B. 在反应CaH2+2H2O===Ca(OH)2+2H2↑中,水作氧化剂
C. 反应3NO2+H2O===2HNO3+NO中氧化剂和还原剂的物质的量之比是3∶1
D. Cl2的氧化性强于I2的氧化性,故置换反应I2+2NaClO3===2NaIO3+Cl2不能发生
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】由工业级碳酸锂(含有少量碳酸镁等杂质)制备高纯碳酸锂。实验过程如下:

(1)实验室中在右图所示装置中进行碳化反应:

① 碳化反应的主要反应离子方程式为__________。
② 碳化时温度需控制在 30℃,可采取的措施是_________。 温度不宜过高的原因是________。
(2)用 CO2调 pH 为 8~9,其目的是__________。
(3)已知在不同温度下蒸发分解碳酸锂的产率与溶解度关系如图:

90℃以下,随温度升高,碳酸锂产率升高的原因可能是__________。
(4)请补充完整由滤液制备高纯碳酸锂的实验方案:取滤液放置于烧杯中___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数和温度的关系如下:
C(g)+D(g)的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=_______;△H=_______0(选填“>”、“<”或“=”)。
(2)830℃时,向一个5L的密闭容器中充入0.40mol的A和0.60mol的B,反应在6min时达到平衡状态。
①该段时间内A的平均反应速率v(A)=__________,达到平衡时B的转化率为_________。
②如果这段时间内体系向外释放48kJ的热量,写出该反应的热化学方程式:_________。
③此时向该密闭容器中充入1mol氩气,平衡时A的转化率_______(选填“增大”、“减小”、“不变”)。
(3)判断该反应达到平衡的依据为_________(填正确选项的字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
e.单位时间内生成amolA的同时,消耗amolB
(4)1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数的值为_________。
A(g)+B(g)的平衡常数的值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的说法中,正确的是( )
A. 实验后剩余的钠粒,不能放回原试剂瓶中
B. 钠着火后,可用泡沫灭火器来灭火
C. 钠的化学性质比较活泼,少量的钠可以保存在与钠不反应的煤油中
D. 当钠与硫酸铜溶液反应时,有大量红色固体铜出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述正确的是( ) 
A.做该实验时环境温度为22℃
B.该实验表明化学能可能转化为热能
C.NaOH溶液的浓度约为1.5mol/L
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在O2、O3、 ![]() C、
C、 ![]() N、
N、 ![]() O、
O、 ![]() Cl、
Cl、 ![]() Cl中:
Cl中:
(1)和互为同素异形体
(2)和_互为同位素.
(3)和的质量数相等,但不能互称为同位素.
(4)和的中子数相等,但质子数不相等,所以不是同一种元素.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定.回答下列问题: 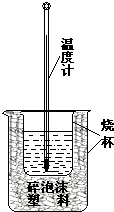
(1)如图装置中,为了酸碱能更充分地反应,应该增加一个(填玻璃仪器名称);大烧杯上没有盖上硬纸板,测得的中和热数值将会(填“偏大”、“偏小”或“无影响”).
(2)在操作正确的前提下提高中和热测定的准确性的关键是( 填代号)
A.进行实验时的气温
B.装置的保温隔热效果
C.实验所用酸碱溶液的体积
(3)如果用0.5 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”的数值将(填“偏大”、“偏小”、“不变”);原因是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2通入BaCl2溶液中并不产生沉淀,在下图右侧的Y形管中放置合适的药品,进行合理操作,在BaCl2溶液中可以看到白色沉淀.右侧Y形管中放的药品是

A. Cu和浓硝酸 B. CaO和浓氮水 C. Na2SO3和较浓硫酸 D. KMnO4溶液和浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要意义。
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等。
已知:
Fe2O3(s)+3CO(s,石墨)═2Fe(s)+3CO2(g)△H1=+489.0kJmol﹣1
C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJmol﹣1
则CO还原Fe2O3(s)的热化学方程式为_____。
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H
CH3OH(g)+H2O(g)△H
①取一定体积CO2和H2的混合气体(物质的量之比为1:3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H____0(填“>”、“<”或“=”,下同)。
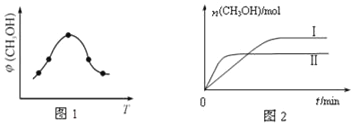
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ_____KⅡ。
(3)以CO2为原料还可以合成多种物质。
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成.开始以氨碳比![]() =3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_____。
=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为_____。
②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10﹣5,碳酸一级电离常数Ka=4.3×10﹣7,则NH4HCO3溶液呈_____(填“酸性”、“中性”或“碱性”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com