
A、NaCl的电子式: |
B、CO2的分子模型示意图: |
C、CrO5的结构式为: 该氧化物中Cr为+6价 该氧化物中Cr为+6价 |
| D、次氯酸的结构式:H-Cl-O |
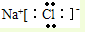 ,故A错误;
,故A错误; ,故B错误;
,故B错误; ,该氧化物中氧元素化合价为-2、-1价,则Cr的化合价为+6价,故C正确;
,该氧化物中氧元素化合价为-2、-1价,则Cr的化合价为+6价,故C正确;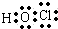 ,将共用电子对换成短线即为结构式,次氯酸的结构式为H-O-Cl,故D错误;
,将共用电子对换成短线即为结构式,次氯酸的结构式为H-O-Cl,故D错误;

科目:高中化学 来源: 题型:
| A、1 mol物质的质量就是该物质的摩尔质量 |
| B、1 mol气体的体积就是气体摩尔体积 |
| C、1 mol任何粒子的相应粒子数叫做阿伏加德罗常数 |
| D、1 mol HCl溶于1 L水中,所得盐酸的物质的量浓度为1 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向100mL 0.1mol/L的溴化亚铁溶液中通入0.05mol的氯气时发生反应的离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| B、向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-═Al(OH)3↓+NH3?H2O+2BaSO4↓ |
| C、用侯氏制碱法制得NaHCO3 Na++NH3+CO2+H2O═NaHCO3↓+NH4+ |
D、向水杨酸( )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水中通入过量的CO2:Ca2++2OH-+CO2═CaCO3↓+H2O |
| B、用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、二氧化硅与烧碱溶液反应:SiO2+2OH-═SiO32-+H2O |
| D、硅酸和烧碱溶液中和:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
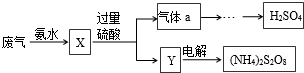
| A、X可能含有2种盐 |
| B、a是SO3 |
| C、Y中含NH4HSO4 |
| D、(NH4)2S2O8中S的化合价不可能为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )
短周期元素R、T、Q、W、G在元素周期表中的相对位置如图所示,其中Q是无机非金属材料的主角.下列判断正确的是( )| A、离子半径:T<W<G |
| B、等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多 |
| C、最简单气态氢化物的热稳定性:Q<R |
| D、T和G组成的化合物溶于水,其水溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
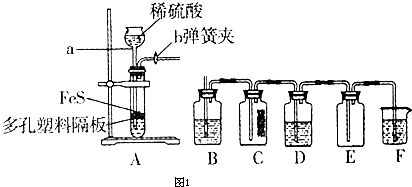

| 实验操作 | 实验现象 | |
| 实验l | 将等浓度的Na2S和Na2SO3溶液按体积比2:1混合 | 无明显现象 |
| 实验2 | 将H2S通入Na2SO3溶液中 | 未见明显沉淀,再加入少量稀硫酸,立即产生大量浅黄色沉淀 |
| 实验3 | 将SO2通入Na2S溶液中 | 有浅黄色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com