
【题目】现有下列物质:①乙炔 ②苯酚溶液 ③乙醛 ④淀粉溶液 ⑤氨基酸.请回答:
(1)遇碘水呈蓝色的是(填序号,下同).
(2)能发生成肽反应的是 .
(3)能跟溴发生加成反应的是 .
(4)能跟银氨溶液发生银镜反应的是 .
(5)能跟饱和溴水反应生成白色沉淀的是 .
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列反应最能体现“原子经济”的是
A. 甲烷与氯气制备一氯甲烷 B. 乙烯聚合为聚乙烯高分子材料
C. 以铜和浓硝酸为原料生产硝酸铜 D. 用苯和浓硝酸反应制取硝基苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为_____________________________。
(2)反应AX3(g)+X2(g)![]() AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=______________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为____________(填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b__________________,c_______________________________。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为______________;实验a和c的平衡转化率:αa为________,αc为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不属于氮的固定的方法是( )
A. 根瘤菌把氮气变为硝酸盐 B. 氮气和氢气合成氨
C. 从液态空气中分离氮气 D. 氮气和氧气合成一氧化氮
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列说法正确的是( )
A.聚乙烯(PE)和聚氯乙烯(PVC)都是食品级塑料制品的主要成分
B.煎炸食物的花生油和牛油都是可皂化的饱和酯
C.粮食酿酒经过了淀粉→葡萄糖→乙醇的化学变化过程
D.大豆富含蛋白质,将其磨成豆浆并煮沸后蛋白质变成了氨基酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一份溶液中可能大量含有K+、A13+、H+、NH4+、Cl-、Br-、I-、ClO-、A1O2-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示:
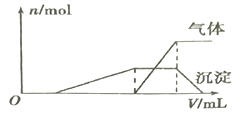
则该溶液中一定存在的离子是________,一定不大量存在的离子是__________。
(2)经检测后,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-、与通入氯气的体积(标准状况下)关系如下表所示,回答下列问题:
Cl2的体积(标准状况下) | 2.8 L | 5.6 L | 11.2 L |
n(Cl-) | 1.25 mol | 1.5 mol | 2 mol |
n(Br-) | 1.5 mol | 1.4 mol | 0.9 mol |
n(I-) | a mol | 0 | 0 |
当通入的氯气为2.8L(标准状况下)时,溶液中发生反应的离子方程式为___________,原溶液中n(Cl-)为____mol;通入氯气的体积在2.8L~5.6L(标准状况下)之间时的有关离子方程式为(如有多个反应,请分开书写)_________________,原溶液中Cl-、Br-、I-的物质的量浓度之比为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度,在实验室中进行如下实验,请完成下列填空:
(1) 配制100mL 0.10mol/L NaOH标准溶液。
(2)取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的现象是_______________________________________,此时锥形瓶内溶液的pH为________。
②根据上述数据,可计算出该盐酸的浓度约为____________________(保留两位有效数字)
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______。
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com