
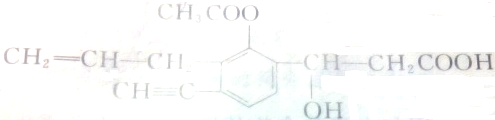
分析 根据有机物结构简式可确定有机物分子式,有机物含有碳碳双键、碳碳三键、酯基、羟基以及羧基,结合苯环的平面形结构特点解答该题.
解答 解:(1)有结构简式可知分子式为C16H16O5,故答案为:C16H16O5;
(2)与双键相连的碳原子为不饱和碳原子,有12个不饱和碳原子;分子中含有C=C、C=O两种双键,故答案为:12;2;
(3)饱和碳原子核外四个电子全部与其他原子形成共用电子对,并且只形成单键,分子中的饱和碳原子有4个;与苯环直接相连的原子与苯环共平面,C≡C为直线形,则分子中一定与苯环处于同一平面的碳原子数有10个,故答案为:4;10.
点评 本题考查有机物结构和性质,为高频考点,侧重于学生的分析能力的考查,明确官能团及性质的关系即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | O2>I2>S | B. | H2S>NaI>H2O | C. | S>I2>O2 | D. | H2O>NaI>H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用pH计测得某稀盐酸的pH为1.54 | |
| C. | 广泛pH试纸润湿后,测得某溶液的pH为2.3 | |
| D. | 用标准的盐酸滴定待测的NaOH溶液时,滴定完毕后,酸式滴定管中盐酸的读数为17.1mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铷的密度比钠小,熔点比钠高 | |
| B. | 铷与冷水不反应,但与热水反应,并放出氢气 | |
| C. | 铷盐大多数易溶于水 | |
| D. | 铷的原子半径和离子半径都比钠小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com