
| A. | 将水库的钢闸门与电源负极相连或将锌块焊接于闸门上以防止其生锈 | |
| B. | 用于文物年代鉴定的放射性14C和作为原子量标准的12C,化学性质不同 | |
| C. | 苯酚、甲醛分别可用于环境消毒和鱼肉等食品的防腐保鲜 | |
| D. | NO2和SO2都是酸性氧化物,都是大气污染物 |
分析 A.与电源负极相连,为外加电源的阴极保护法,将锌块焊接于闸门上为牺牲阳极的阴极保护法;
B.放射性14C和作为原子量标准的12C,均为C原子;
C.苯酚、甲醛有毒;
D.NO2不是酸性氧化物.
解答 解:A.与电源负极相连,为外加电源的阴极保护法,将锌块焊接于闸门上为牺牲阳极的阴极保护法,均可防止其生锈,故A正确;
B.放射性14C和作为原子量标准的12C,均为C原子,化学性质相同,故B错误;
C.苯酚、甲醛有毒,不能作食品保鲜剂,故C错误;
D.NO2不是酸性氧化物,二者均为大气污染物,故D错误;
故选A.
点评 本题考查物质的组成、结构与性质,为高频考点,把握物质的性质、应用及化学与生活的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 8种 | C. | 16种 | D. | 24种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 诗句 | 相关物质 | 相关说法 |
| A | 春蚕到死丝方尽 | 纤维素 | 高分子化合物 |
| B | 蜡炬成灰泪始干 | 脂肪烃 | 不饱和烃 |
| C | 沧海月明珠有泪 | 碳酸钙 | 强电解质 |
| D | 蓝田日暖玉生烟 | 二氧化硅 | 两性氧化物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置甲制取氯气 | |
| B. | 用装置乙干燥氨气 | |
| C. | 用装置丙除去甲烷中混有的乙烯 | |
| D. | 利用装置丁制取硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物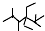 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| C. | 1 mol乙酸在浓H2SO4存在下与足量乙醇反应可得1 mol乙酸乙酯 | |
| D. | 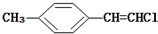 分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的结构简式为HCOOCH2CH3 | B. | Y的分子中不含-CH3(甲基) | ||
| C. | Z不具有氧化性 | D. | Z分子中含有甲基且具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com