
”¾ĢāÄæ”æĻÖÓŠ8ÖÖŌŖĖŲµÄŠŌÖŹ”¢Źż¾ŻČēĻĀ±ķĖłĮŠ£¬ĖüĆĒŹōÓŚµŚ¶ž»ņµŚČżÖÜĘŚ£®
¢Ł | ¢Ś | ¢Ū | ¢Ü | ¢Ż | ¢Ž | ¢ß | ¢ą | |
Ō×Ó°ė¾¶£Ø10©10m£© | 0.74 | 1.60 | 0.89 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
×īøß»ņ×īµĶ»ÆŗĻ¼Ū | +2 | +2 | +5 | +7 | +1 | +5 | +3 | |
©2 | ©3 | ©1 | ©3 |
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©¢ŪµÄŌŖĖŲ·ūŗÅŹĒ £¬ ¢ŁµÄŌŖĖŲĆū³ĘŹĒ £®
£Ø2£©ŌŚÕā8ÖÖŌŖĖŲµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļÖŠ£¬ĖįŠŌ×īĒæµÄ»ÆŗĻĪļµÄĆū³ĘŹĒ £® ¢ŚÓė¢ŻŠĪ³ÉµÄ»ÆŗĻĪļµÄµē×ÓŹ½ŹĒ£ŗ £¬ Źō»ÆŗĻĪļ£ØĢī”°Ąė×Ó”±»ņ”°¹²¼Ū”±£©£®
£Ø3£©±Č½Ļ¢ÜŗĶ¢ßµÄĒā»ÆĪļµÄĪČ¶ØŠŌ£ØÓĆ·Ö×ÓŹ½±ķŹ¾£© £®
£Ø4£©Š“³ö¢Ž×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļøś¢ąµÄ×īøß¼ŪŃõ»ÆĪļ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ £®
£Ø5£©ĒėÉč¼ĘŹµŃé±Č½Ļµ„ÖŹ¢Ś¢ąµÄ½šŹōŠŌ£¬Š“³ö¼ņµ„µÄŹµŃé²½ÖčŗĶĻÖĻó£ŗ £®
”¾“š°ø”æ
£Ø1£©Be£»Ńõ
£Ø2£©øßĀČĖį£»![]() £»Ąė×Ó
£»Ąė×Ó
£Ø3£©NH3£¾PH3
£Ø4£©Al2O3+2OH©=2AlO2©+H2O
£Ø5£©Č”Ņ»Š”¶ĪĆ¾ĢõŗĶŅ»Š”ʬĀĮʬ£¬Ä„Č„±ķĆęŃõ»ÆĤ£¬·Ö±š·ÅČė2Ö§ŹŌ¹ÜÖŠ£¬ø÷¼ÓČėµČĢå»żµČÅØ¶ČµÄŃĪĖį£¬Ć¾ÓėŃĪĖį·“Ó¦±ČĀĮ¾ēĮŅ
”¾½āĪö”æ½ā£ŗÓÉŌŖĖŲµÄŠŌÖŹæÉÖŖ£¬¢ŁÖ»ÓŠ©2¼Ū£¬Ōņ¢ŁĪŖO£»¢Ü”¢¢ßÖŠ»ÆŗĻ¼ŪĻąĶ¬£¬°ė¾¶²»Ķ¬£¬Ōņ¢ÜĪŖP£¬¢ßĪŖN£»¢ŻĪŖCl£¬½įŗĻŌ×Ó°ė¾¶æÉÖŖ£¬¢ŚĪŖMg£¬¢ŪĪŖBe£¬¢ŽĪŖNa£¬¢ąĪŖAl£¬£Ø1£©¢ŪµÄŌŖĖŲ·ūŗÅŹĒBe£»¢ŁµÄŌŖĖŲĆū³ĘŹĒŃõ£¬ĖłŅŌ“š°øŹĒ£ŗBe£»Ńõ£»£Ø2£©Õā8ÖÖŌŖĖŲµÄ×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļÖŠ£¬ĖįŠŌ×īĒæµÄ»ÆŗĻĪļµÄĆū³ĘŹĒøßĀČĖį£®¢ŚÓė¢ŻŠĪ³ÉµÄ»ÆŗĻĪļĪŖMgCl2 £¬ Ęäµē×ÓŹ½ŹĒ ![]() £¬ŗ¬Ąė×Ó¼ü£¬ĪŖĄė×Ó»ÆŗĻĪļ£¬ĖłŅŌ“š°øŹĒ£ŗøßĀČĖį£»
£¬ŗ¬Ąė×Ó¼ü£¬ĪŖĄė×Ó»ÆŗĻĪļ£¬ĖłŅŌ“š°øŹĒ£ŗøßĀČĖį£» ![]() £»Ąė×Ó£»£Ø3£©·Ē½šŹōŠŌN£¾P£¬Ōņ¢ÜŗĶ¢ßµÄĒā»ÆĪļµÄĪČ¶ØŠŌĪŖNH3£¾PH3 £¬ ĖłŅŌ“š°øŹĒ£ŗNH3£¾PH3£»£Ø4£©¢Ž×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļøś¢ąµÄ×īøß¼ŪŃõ»ÆĪļ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖAl2O3+2OH©=2AlO2©+H2O£¬ĖłŅŌ“š°øŹĒ£ŗAl2O3+2OH©=2AlO2©+H2O£»£Ø5£©½šŹōŠŌMg£¾Al£¬Éč¼ĘµÄ¼ņµ„µÄŹµŃé²½ÖčŗĶĻÖĻóĪŖČ”Ņ»Š”¶ĪĆ¾ĢõŗĶŅ»Š”ʬĀĮʬ£¬Ä„Č„±ķĆęŃõ»ÆĤ£¬·Ö±š·ÅČė2Ö§ŹŌ¹ÜÖŠ£¬ø÷¼ÓČėµČĢå»żµČÅØ¶ČµÄŃĪĖį£¬Ć¾ÓėŃĪĖį·“Ó¦±ČĀĮ¾ēĮŅ£Ø »ņÓėČČĖ®”¢Ōµē³Ų”¢×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļµÄ¼īŠŌ±Č½ĻµČ£©£¬ĖłŅŌ“š°øŹĒ£ŗČ”Ņ»Š”¶ĪĆ¾ĢõŗĶŅ»Š”ʬĀĮʬ£¬Ä„Č„±ķĆęŃõ»ÆĤ£¬·Ö±š·ÅČė2Ö§ŹŌ¹ÜÖŠ£¬ø÷¼ÓČėµČĢå»żµČÅØ¶ČµÄŃĪĖį£¬Ć¾ÓėŃĪĖį·“Ó¦±ČĀĮ¾ēĮŅ£®
£»Ąė×Ó£»£Ø3£©·Ē½šŹōŠŌN£¾P£¬Ōņ¢ÜŗĶ¢ßµÄĒā»ÆĪļµÄĪČ¶ØŠŌĪŖNH3£¾PH3 £¬ ĖłŅŌ“š°øŹĒ£ŗNH3£¾PH3£»£Ø4£©¢Ž×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļøś¢ąµÄ×īøß¼ŪŃõ»ÆĪļ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖAl2O3+2OH©=2AlO2©+H2O£¬ĖłŅŌ“š°øŹĒ£ŗAl2O3+2OH©=2AlO2©+H2O£»£Ø5£©½šŹōŠŌMg£¾Al£¬Éč¼ĘµÄ¼ņµ„µÄŹµŃé²½ÖčŗĶĻÖĻóĪŖČ”Ņ»Š”¶ĪĆ¾ĢõŗĶŅ»Š”ʬĀĮʬ£¬Ä„Č„±ķĆęŃõ»ÆĤ£¬·Ö±š·ÅČė2Ö§ŹŌ¹ÜÖŠ£¬ø÷¼ÓČėµČĢå»żµČÅØ¶ČµÄŃĪĖį£¬Ć¾ÓėŃĪĖį·“Ó¦±ČĀĮ¾ēĮŅ£Ø »ņÓėČČĖ®”¢Ōµē³Ų”¢×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļµÄ¼īŠŌ±Č½ĻµČ£©£¬ĖłŅŌ“š°øŹĒ£ŗČ”Ņ»Š”¶ĪĆ¾ĢõŗĶŅ»Š”ʬĀĮʬ£¬Ä„Č„±ķĆęŃõ»ÆĤ£¬·Ö±š·ÅČė2Ö§ŹŌ¹ÜÖŠ£¬ø÷¼ÓČėµČĢå»żµČÅØ¶ČµÄŃĪĖį£¬Ć¾ÓėŃĪĖį·“Ó¦±ČĀĮ¾ēĮŅ£®


 Ļ°Ģā¾«Ń”ĻµĮŠ“š°ø
Ļ°Ģā¾«Ń”ĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æA”¢D”¢E”¢WŹĒ֊ѧ³£¼ūµÄĖÄÖÖŌŖĖŲ£¬Ō×ÓŠņŹżŅĄ“ĪŌö“ó”£AµÄŌ×Ó×īĶā²ćµē×ÓŹżŹĒ“ĪĶā²ćµÄ2±¶£¬DµÄŃõ»ÆĪļŹōÓŚĮ½ŠŌŃõ»ÆĪļ£¬D”¢EĪ»ÓŚĶ¬ÖÜĘŚ£¬A”¢D”¢EµÄŌ×Ó×īĶā²ćµē×ÓŹżÖ®ŗĶĪŖ14£¬WŹĒČĖĢå±ŲŠčµÄĪ¢ĮæŌŖĖŲ£¬Č±·¦W»įµ¼ÖĀʶŃŖ֢ד”£
£Ø1£©AŌŚŌŖĖŲÖÜĘŚ±ķÖŠµÄĪ»ÖĆŹĒ__________________”£
£Ø2£©ĻĀĮŠŹĀŹµÄÜÓĆŌŖĖŲÖÜĘŚĀɽāŹĶµÄŹĒ_____(Ģī×ÖÄøŠņŗÅ£©”£
a . DµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦Ė®»ÆĪļµÄ¼īŠŌČõÓŚMg(OH)2
b. EµÄĘųĢ¬Ēā»ÆĪļµÄĪČ¶ØŠŌŠ”ÓŚHF
c. WE3µÄČÜŅŗæÉÓĆÓŚæĢŹ“ĶÖʵÄÓ”Ė¢µēĀ·°å
£Ø3£©EµÄµ„ÖŹæÉŅŌ“ÓNaBrČÜŅŗÖŠÖĆ»»³öBr2µ„ÖŹ£¬“ÓŌ×Ó½į¹¹µÄ½Ē¶Č½āŹĶĘäŌŅņŹĒ__________”£
£Ø4£©¢Ł¹¤ŅµÉĻÓƵē½ā·ØÖʱøDµÄµ„ÖŹ£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ____________________”£
¢Ś¼ŅÓĆ”°¹ÜµĄĶØ”±µÄÓŠŠ§³É·ÖŹĒÉÕ¼īŗĶDµÄµ„ÖŹ£¬Ź¹ÓĆŹ±Šč¼ÓČėŅ»¶ØĮæµÄĖ®£¬“ĖŹ±·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ____________________”£
£Ø5£©WµÄµ„ÖŹæÉÓĆÓŚ“¦ĄķĖįŠŌ·ĻĖ®ÖŠµÄNO3-£¬Ź¹Ęä×Ŗ»»ĪŖNH4+£¬Ķ¬Ź±Éś³ÉÓŠ“ÅŠŌµÄWµÄŃõ»ÆĪļX£¬ŌŁ½ųŠŠŗóŠų“¦Ąķ”£
¢Ł ÉĻŹö·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ__________”£
¢Ś DµÄµ„ÖŹÓėXŌŚøßĪĀĻĀ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ__________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĪļÖŹÖŠÓė¼×Ķ黄ĪŖĶ¬ĻµĪļµÄŹĒ £Ø £©
A.C2H4B.C2H2C.C6H6D.C3H8
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖXŹĒŅ»ÖÖ¾§Ģ壬ŌŚŅ»¶ØĢõ¼žĻĀæÉ·¢ÉśČēĶ¼ĖłŹ¾µÄ±ä»Æ”£ĻĀĮŠŠšŹöÕżČ·µÄŹĒ

¢ŁXæÉÄÜŹĒĀĮ»ņ¹č ¢ŚXæÉÄÜŹĒŌ×Ó¾§Ģå»ņ½šŹō¾§Ģå
¢ŪWŅ»¶ØŹĒĮ½ŠŌĪļÖŹ ¢ÜW¾§ĢåµÄČŪµćŗÜøß
A. ¢Ł¢Ś¢Ū B. ¢Ł¢Ś¢Ü C. Ö»ÓŠ¢Ū D. ¢Ū¢Ü
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æÓĆNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£ŹżµÄŹżÖµ£¬ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A. ·“Ó¦Cu2S+O2![]() 2Cu+SO2Éś³É1molCu,µē×Ó×ŖŅĘŹżĪŖ3NA
2Cu+SO2Éś³É1molCu,µē×Ó×ŖŅĘŹżĪŖ3NA
B. ³£ĪĀŹ±£¬2L1mol/LµÄ“×ĖįČÜŅŗÖŠ£¬Ėłŗ¬·Ö×Ó×ÜŹżŠ”ÓŚ2 NA
C. 1molFeC13ČÜÓŚĖ®ÖŠ£¬ČÜŅŗÖŠĄė×ÓŹżĪŖ4 NA
D. 1molNH2-ÖŠŗ¬µē×ÓŹżĪŖNA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ»ÆѧÓėÉś»īĆÜĒŠĻą¹Ų”£ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ£Ø £©
A.“ÅŠŌŃõ»ÆĢśæÉÓĆ×÷ŗģÉ«ÓĶĘįŗĶĶæĮĻ
B.ĘÆ°×·ŪæÉÓĆÓŚÉś»īÓĆĖ®µÄĻū¶¾
C.ĒāŃõ»ÆĀĮæÉÓĆÓŚÖŠŗĶ¹ż¶ąĪøĖį
D.¹č½ŗæÉÓĆ×÷“ü×°Ź³Ę·µÄøÉŌļ¼Į
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ25”ꏱ£¬¼øÖÖČõĖįµÄµēĄėĘ½ŗā³£ŹżČēĻĀ£ŗ
ČõĖį | CH3COOH | H2CO3 | H2SO3 |
µēĄėĘ½ŗā³£Źż | K=1.8”Į10-5 | K1=4.3”Į10-7 K2=5.6”Į10-11 | K1=1.5”Į10-2 K2=1.02”Į10-7 |
£Ø1£©CH3COOH”¢H2CO3”¢H2SO3ČżÖÖĖįÖŠĖįŠŌ×īČõµÄŹĒ__________(Ģī»ÆѧŹ½)”£
£Ø2£©CH3COOHµÄµēĄėĘ½ŗā³£Źż±ķ“ļŹ½ĪŖK=__________”£
£Ø3£©Š“³öH2CO3µÄµŚ¶ž²½µēĄė·½³ĢŹ½£ŗ_____________”£
£Ø4£©Š“³öH2SO3ČÜŅŗŗĶCH3COONaČÜŅŗ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ____________________”£
£Ø5£©½«Ģå»ż¾łĪŖ10mL”¢pH¾łĪŖ2µÄ“×ĖįČÜŅŗÓėŅ»ŌŖĖįHX·Ö±š¼ÓĖ®Ļ”ŹĶÖĮ1000mL£¬Ļ”ŹĶ¹ż³ĢÖŠpHµÄ±ä»ÆČēĶ¼ĖłŹ¾£¬ŌņHXµÄµēĄėĘ½ŗā³£Źż____________(Ģī”°“óÓŚ”±”° Š”ÓŚ”±»ņ”°µČÓŚ”±)“×ĖįµÄµēĄėĘ½ŗā³£Źż£¬ĄķÓÉŹĒ__________________”£
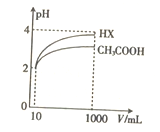
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æNA±ķŹ¾°¢·ü¼ÓµĀĀŽ³£Źż”£ĻĀĮŠŠšŹöÖŠÕżČ·µÄŹĒ£Ø £©
A.±ź×¼×“æöĻĀ£¬2.24LĖ®ÖŠŗ¬HŌ×ӵďżÄæĪŖ0.2NA
B.1L 0.1 mol”¤L£1KNO3ČÜŅŗĄļŗ¬OŌ×ӵďżÄæĪŖ0.3NA
C.2.3gÄĘ·“Ӧɜ³ÉNa2OŗĶNa2O2µÄ»ģŗĻĪļ£¬×ŖŅʵē×ӵďżÄæĪŖ0.1NA
D.1mol H3O£«ŗĶ1molNH4£«ÖŠŗ¬ÖŹ×ӵďżÄæ¾łĪŖ10NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ°Ń¹żŃõ»ÆÄĘĶ¶Čėŗ¬ÓŠHCO3-”¢Cl-”¢Mg2+”¢Na+µÄĖ®ČÜŅŗÖŠ£¬Ąė×ÓŹżÄæ²»±äµÄŹĒ£Ø £©
A. HCO3- B. Cl- C. Mg2+ D. Na+
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com