
(1)氨气易溶于水生成氨水,氨水电离生成铵根离子,铵根离子中氮原子采取________杂化,NH4+中H—N—H键角比NH3中H—N—H键角大,原因是__________________。
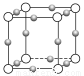
(2)Cu3N形成的晶体结构如图所示,N3-的配位数是________________。
(3)常温常压下,给水施加一个弱电场便可形成冰,称之为“热冰”,热冰中微粒间存在的作用力有________,其大小顺序是__________。
(4)NaF和NaCl属于同一主族的钠盐,但NaF的莫氏硬度比NaCl大,原因是__________。
(1)sp3 氨气分子中氮原子上有一对孤电子对,铵根离子中氮原子上没有孤电子对,排斥力小
(2)6
(3)化学键、范德华力、氢键 化学键>氢键>范德华力
(4)相同类型的离子晶体,晶格能与离子半径成反比,离子晶体的晶格能越大,其莫氏硬度越大,氟离子半径小于氯离子半径,所以氟化钠的晶格能大于氯化钠,则NaF的莫氏硬度比NaCl大
【解析】(1)铵根离子中含有4个键,没有孤电子对,氮原子采取sp3杂化,氨气分子中氮原子上有一对孤电子对,铵根离子中氮原子上没有孤电子对,排斥力小。
(2)○∶8×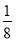 =1
=1
 ∶12×
∶12×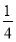 =3
=3
所以○代表N3-, 代表Cu+
代表Cu+
N3-的配位数为6(上下、前后、左右)。
(3)热冰中微粒间存在的作用力有化学键、范德华力、氢键,微粒间作用力大小顺序是化学键>氢键>范德华力。
(4)相同类型的离子晶体,晶格能与离子半径成反比,离子晶体的晶格能越大,其莫氏硬度越大,氟离子半径小于氯离子半径,所以氟化钠的晶格能大于氯化钠,则NaF的莫氏硬度比NaCl大。


科目:高中化学 来源:2014高考化学二轮复习限时集训 专题12有机物的结构与性质练习卷(解析版) 题型:选择题
C5H11OH经氧化后可生成相应的羧酸C4H9COOH的同分异构体最多有( )
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题四氧化还原反应练习卷(解析版) 题型:选择题
a mol FeS与b mol Fe3O4投入到V L c mol·L-1的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为( )
A.(a+3b) mol B.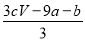 mol
mol
C. mol D.(cV-3a-9b) mol
mol D.(cV-3a-9b) mol
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十四常见有机物及其应用练习卷(解析版) 题型:选择题
物质X的结构简式如图所示,它常被用于制香料或作为饮料的酸化剂,在医学上也有广泛用途。下列关于物质X的说法正确的是( )
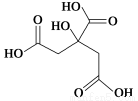
A.X的分子式为C6H7O7
B.1 mol物质X最多可以和3 mol氢气发生加成反应
C.X分子内所有原子均在同一平面内
D.足量的X分别与等物质的量的NaHCO3、Na2CO3反应得到的气体的物质的量相同
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十四常见有机物及其应用练习卷(解析版) 题型:选择题
下列关于有机物的正确说法是( )
A.煤干馏可以得到汽油、煤油、柴油等
B.聚乙烯分子中含有碳碳单键和碳碳双键
C.乙烷、乙醇、乙酸都能与钠反应生成氢气
D.淀粉和纤维素的水解产物相同
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十五综合实验探究练习卷(解析版) 题型:填空题
氯酸镁晶体[Mg(ClO3)2·6H2O]可用作棉花收获前脱叶剂、小麦催熟剂、除草剂、干燥剂。实验室制备少量Mg(ClO3)2的操作步骤如下:
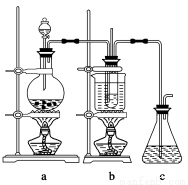
(1)制备NaClO3晶体:在实验室里可用如图所示装置制取NaClO3。图中:a为氯气发生装置;b为NaClO3的制备装置;c为尾气吸收装置。
①装置a中反应的离子方程式为____________________________
②工业上用石灰乳代替烧碱溶液吸收尾气的原因是___________________________
③装置b中发生反应的化学方程式为3Cl2+6NaOH 5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
5NaCl+NaClO3+3H2O,请推测在加热NaClO溶液时发生反应的化学方程式:______________________________。
(2)制备氯酸镁晶体:由上述提纯制得的NaClO3和MgCl2按化学反应方程式计量数之比混合可制得Mg(ClO3)2,原理为MgCl2+2NaClO3=Mg(ClO3)2+2NaCl。已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
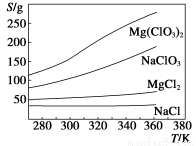
请补充由(1)制得的NaClO3制备Mg(ClO3)2·6H2O的操作步骤:
①按计量数之比将MgCl2和NaClO3混合溶于85 ℃的热水中,加热蒸发;
②______________________;
③______________________;
④重结晶。
(3)问题讨论:①用60 ℃ Na2CO3溶液吸收Cl2也可制得NaClO3,请写出该反应的化学方程式:__________________________________________。
②制备氯酸镁晶体时最后进行重结晶操作的目的是___________________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十二常见非金属元素练习卷(解析版) 题型:填空题
(1)下列与含氯化合物有关的说法正确的是________(填字母)。
A.HClO是弱酸,所以NaClO是弱电解质
B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物
D.电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)
(2)无水AlCl3(183 ℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
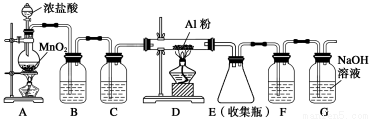
装置B中盛放饱和NaCl溶液,该装置的主要作用是______________。F中试剂的作用是____________________。用一件仪器装填适当试剂后可同时起到F和G的作用,所装填的试剂为________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题十三无机化学综合应用练习卷(解析版) 题型:选择题
有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常见的无机试剂。E的溶质是一种无色油状液体,B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其他五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3沉淀均不溶。
根据上述实验信息,下列说法错误的是( )
A.B可能为NaHCO3溶液
B.F为AgNO3溶液
C.D不可能是镁或铝的盐酸盐
D.A为氨水,E为硫酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com