
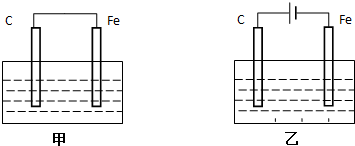
 如图所示,是原电池的装置图.请回答:
如图所示,是原电池的装置图.请回答:分析 (1)铁作负极,原电池反应是铁与稀硫酸置换氢气的反应,正极反应是氢离子得电子生成氢气,负极上是金属铁失电子,据此回答;
(2)根据方程式中物质发生的反应类型判断,Cu发生氧化反应,作负极,B极材料是比Cu不活泼的导电物质,溶液C中含有Fe3+;
(3)CuCl2溶液、Zn、Cu构成的原电池,反应是Zn和氯化铜之间的反应,据此确定电极材料以及电极反应.
解答 解:(1)铁作负极,则该原电池反应是铁与稀硫酸置换氢气的反应,所以正极反应是氢离子得电子生成氢气,电极反应式为2H++2e-═H2↑;溶液中氢离子放电,导致溶液中氢离子浓度减小,pH升高,
故答案为:2H++2e-═H2↑;升高;
(2)Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的原电池装置,根据方程式中物质发生的反应类型判断,Cu发生氧化反应,作原电池的负极,所以A材料是Cu,B极材料是比Cu不活泼的导电物质如石墨、Ag等即可.溶液C中含有Fe3+,如FeCl3溶液;故答案为:Cu;石墨;FeCl3溶液;
(3)Zn比较活泼,在原电池中做负极,Cu做正极,正极发生还原反应,Cu2+在正极得到电子变成Cu,电极反应为:Cu2++2e-=Cu,Cu2+发生了反应,则c(Cu2+)变小,故答案为:负;还原;Cu2++2e-=Cu;变小.
点评 本题考查对原电池反应原理的应用、电极的判断、电解质溶液的选择、电极反应式的书写等知识,属于综合知识的考查,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 转变为
转变为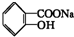 的方法是( )
的方法是( )| A. | 与足量NaOH溶液共热后,再加盐酸 | |
| B. | 溶液加热,通入足量的SO2 | |
| C. | 与稀硫酸共热后,加入足量NaOH溶液 | |
| D. | 与足量稀硫酸共热后,加入足量NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表中的主族都有非金属元素 | |
| B. | 周期表中的主族都有金属元素 | |
| C. | 周期表中的金属元素都位于长周期 | |
| D. | 周期表中的非金属元素都位于主族和0族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 与NaOH水溶液共热,生成的有机物的结构简式为
与NaOH水溶液共热,生成的有机物的结构简式为 ;
; ;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为
;若该有机物有一个反式异构体,且能与氢气加成生成2-甲基戊烷,则该有机物的结构简式为 ;
;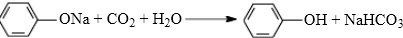 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 21 | C. | 14 | D. | 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
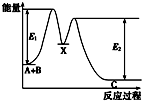 反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E4表示反应A+B→X的活化能,下列有关叙述正确的是( )
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E4表示反应A+B→X的活化能,下列有关叙述正确的是( )| A. | Ee表示反应X→C的活化能 | |
| B. | X是反应A+B→C的催化剂 | |
| C. | 反应A+B→C的△H<0 | |
| D. | 加入催化剂可改变反应A+B→C的焓变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com