
【题目】氮、磷、砷、硫、氯等元素在生产生活和药物合成中用途广泛。回答下列问题:
(1)瑞德西韦是一种抗病毒药物,结构如下。
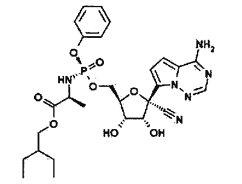
该结构中N、O、P原子的电负性由大到小的顺序为____________。该药物的分子间作用力有____________。
(2)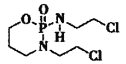 (异环磷酰胺)常用作抗癌药,1mol该物质含
(异环磷酰胺)常用作抗癌药,1mol该物质含![]() 键数目为______NA。
键数目为______NA。
(3)实验测得![]() 中Mn,C,N三种原子不在同一水平线上。则此配合物中配位原子为______,其杂化方式为______。
中Mn,C,N三种原子不在同一水平线上。则此配合物中配位原子为______,其杂化方式为______。
(4)![]() 可用作杀虫剂,其中所含As元素基态原子的价电子排布式为____________,
可用作杀虫剂,其中所含As元素基态原子的价电子排布式为____________,![]() 的空间构型为____________。
的空间构型为____________。
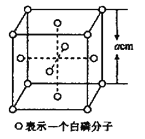
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图所示,已知晶胞参数为acm,阿伏加德罗常数的值为NA,该晶胞中含有的P原子个数为____________,该晶体的密度为![]() ,晶体中白磷分子之间的最短距离为____________cm(用含
,晶体中白磷分子之间的最短距离为____________cm(用含![]() 、NA的式子表示)。
、NA的式子表示)。
【答案】O>N>P 氢键、范德华力 29 S ![]()
![]() 正四面体 16
正四面体 16 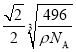
【解析】
根据白磷分子在晶胞中的位置,在1个白磷分子的晶胞中,8个白磷分子位于晶胞的顶点,六个白磷分子位于晶胞的面心,故1个晶胞中白磷分子的个数为![]() ,1个白磷分子中含有4个磷原子,该晶胞中含有的P原子个数为4×4=16,然后计算1mol白磷分子晶胞的质量为
,1个白磷分子中含有4个磷原子,该晶胞中含有的P原子个数为4×4=16,然后计算1mol白磷分子晶胞的质量为![]() ,计算出晶胞参数a。
,计算出晶胞参数a。
(1)同周期主族元素的电负性,从左到右随着元素原子序数的递增,电负性逐渐增强,故N、O、P原子的电负性由大到小的顺序为O>N>P;该药物的分子内含有氨基和羟基,所以该药物的分子间作用力有氢键、范德华力;
(2)1个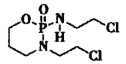 分子中含有29个
分子中含有29个![]() 键,故1mol该物质含
键,故1mol该物质含![]() 键数目为29NA;
键数目为29NA;
(3)SCN-的结构式为![]() ,因为Mn,C,N三种原子不在同一水平线上,所以S原子为配位原子提供孤电子对,形成配位键后,S原子的价层电子对数为4,并且S原子含有2对孤电子对,所以S原子的杂化方式为sp3;
,因为Mn,C,N三种原子不在同一水平线上,所以S原子为配位原子提供孤电子对,形成配位键后,S原子的价层电子对数为4,并且S原子含有2对孤电子对,所以S原子的杂化方式为sp3;
(4)As元素原子序数为33,为第ⅤA族元素,基态原子核外电子排布式为[Ar]3d104s24sp3,故As元素基态原子的价电子排布式为4s24sp3;![]() 的价层电子对数为4,并且中心原子As不含有孤电子对,故
的价层电子对数为4,并且中心原子As不含有孤电子对,故![]() 的空间构型为正四面体;
的空间构型为正四面体;
(5)在1个白磷分子的晶胞中,8个白磷分子位于晶胞的顶点,六个白磷分子位于晶胞的面心,故1个晶胞中白磷分子的个数为![]() ,1个白磷分子中含有4个磷原子,该晶胞中含有的P原子个数为4×4=16;已知晶胞参数为acm,阿伏加德罗常数的值为NA,1mol该晶胞的质量为
,1个白磷分子中含有4个磷原子,该晶胞中含有的P原子个数为4×4=16;已知晶胞参数为acm,阿伏加德罗常数的值为NA,1mol该晶胞的质量为![]() ,a=
,a= 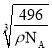 ,晶体中白磷分子的最短距离为该晶胞面对角线的一半,该晶胞的面对角线为
,晶体中白磷分子的最短距离为该晶胞面对角线的一半,该晶胞的面对角线为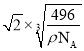 cm,故晶体中白磷分子之间的最短距离为
cm,故晶体中白磷分子之间的最短距离为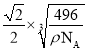 cm。
cm。


科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、M、E、Q均为稀有气体外的短周期元素,,其原子序数依次增大,X的最外层电子数是W的4倍,Z与E的最低负化合价相同,X、M在周期表的位置如图。
X | ||
M | E |
(1)Y在周期表中的位置为________,Q的元素名称为_______。
(2)X的最高价氧化物的电子式为____________________;Y和W形成的五核离子的电子式为_________________。
(3)表中元素原子半径最大的是(写元素符号)________。
(4)X与E的最高价氧化物的水化物反应的化学反应式为___________________________。
(5)下列事实能说明Z元素的非金属性比E元素的非金属性强的是________
①Z单质与E的简单氢化物的溶液反应,溶液变浑浊
②在氧化还原反应中,1mol Z单质比1mol E单质得电子多
③Z和E两元素的简单氢化物受热分解,前者分解温度高
(6)M和Q两元素的单质生成1mol M的最高价化合物,恢复至室温,放热687kJ。已知该化合物的溶沸点分别为—69℃和58℃,写出该反应的热化学方程式:_________
(7)铜与一定浓度的硝酸和硫酸的混酸反应,生成的盐只有硫酸铜,同时生成的两种气体由以上元素中的两种元素组成。气体的相对分子质量都小于50,为防止污染,将产生的气体完全转化为最高价含氧酸,消耗1L 2.2mol/L NaOH溶液和1mol O2,则两种气体的分子式以及物质的量分别为____________________,生成的硫酸铜的物质的量为____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝绿色 | 有无色气泡产生 |
以下结论不正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中发生的反应是离子反应
D.Ⅲ中发生反应的离子方程式为2H++Zn=Zn2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
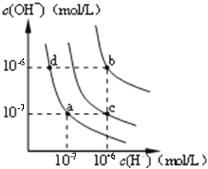


甲 乙 丙
A. 图甲中纯水仅升高温度,就可以从a点变到c点
B. 图甲中在b点对应温度下,将pH=2的H2SO4溶液与pH=10的NaOH溶液等体积混合后,溶液显中性
C. 图乙表相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
D. 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/L,C1-、Br-及I-的混合溶液,由图丙曲线,可确定首先沉淀的是Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是原电池和电解池的组合装置图。请回答:

(1)若甲池某溶液为稀H2SO4,闭合K时,电流表指针发生偏转,电极材料A为碳棒,B为Fe,则:
①A碳电极上发生的现象为___。
②丙池中E、F电极均为碳棒,E电极为__(填“正极”、“负极”、“阴极”或“阳极”)。如何检验F侧出口的产物____。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示甲池的单液原电池装置,则正极反应式为___。
(3)若甲池为氢氧燃料电池,某溶液为KOH溶液,A极通入氢气,
①A电极的反应方程式为:___。②若线路中转移0.02mol电子,则乙池中C极质量改变___g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiCoO2是锂离子电池常用的电极材料。利用原钴矿(含Cr2O3、NiS等杂质)制备LiCoO2的工艺流程如图:
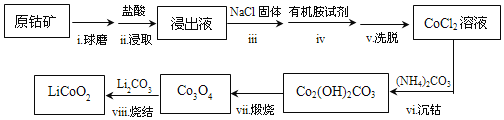
资料:①在含一定量Cl-的溶液中,钻离子以CoCl![]() 形式存在:Co2++4Cl-
形式存在:Co2++4Cl-![]() CoCl
CoCl![]()
②CoCl![]() 溶于有机胺试剂,有机胺不溶于水。
溶于有机胺试剂,有机胺不溶于水。
③盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:
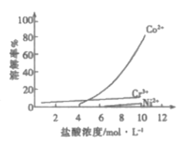
(1)步骤ⅱ选用盐酸的浓度应为___,该过程要注意在通风橱中进行的原因为___(用离子方程式表示)。
a.4mol/L b.6mol/L c.10mol/L
(2)从平街移动角度解释步骤中加入NaCl固体的目的___。
(3)步骤ⅳ的操作是___。
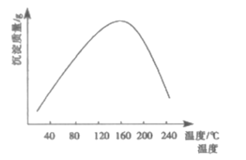
(4)步骤ⅵ用(NH4)2CO3作沉淀剂,在一定条件下得到碱式碳酸钻Co2(OH)2CO3]。已知碱式碳酸钻在339℃以上开始分解,实验测得在一段时间内加入等量(NH4)2CO3所得沉淀质量随反应温度的变化如图所示。分析曲线下降的原因___。
(5)步骤ⅷ中Co3O4和Li2CO3混合后,鼓入空气,经高温烧结得到LiCoO2。该反应的化学方程式是___。
(6)多次实验测定该原钴矿中钴元素的质量分数为1.18%,则原钴矿中Co2O3的质量分数为___%。(假设原钻矿中含钻元素的物质只有Co2O3)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期主族元素,a、d分别是A、D元素对应的单质,m、n、p、q是由这些元素中的部分元素组成的化合物,气体p常作果实催熟剂,m、n为两种常见的液体。上述物质发生的转化关系如图所示(反应条件已略去)。下列说法错误的是( )

A.原子半径由大到小的顺序为:D>B>C>A
B.简单氢化物的沸点B<C
C.d与m反应的现象为d浮在m液面上四处游动
D.C与D形成的化合物中一定含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是

A. 青铜器发生电化学腐蚀,图中c作负极,被氧化
B. 正极发生的电极反应为O2+ 4e-+2H2O=4OH-
C. 环境中的Cl- 与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2 (OH)3Cl↓
D. 若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有C2H4(乙烯)和O2两种气体。
(1)两者的质量相等时,在标准状况下,①体积比为________;②密度比为________;③分子数比为________。
(2)在相同状况下,当两者体积相同时,①质量比为________;②密度比为________;③分子数比为__________。
(3)两者的物质的量相同时,①体积比为________;②密度比为________;③质量比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com