
已知450℃ 时,反应H2(g)+I2(g)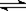 2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g)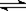 H2(g)+I2(g)的化学平衡常数为
H2(g)+I2(g)的化学平衡常数为
A.50 B.0.02 C.100 D.无法确定
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
一定温度时,向容积为2 L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)  2SO3(g)。反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是( )
2SO3(g)。反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是( )
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
A.反应在0~t1 min内的平均速率为v(SO3)=0.088/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.10 mol SO3和0.010 mol O2,到达平衡时,n(SO2)=0.012 mol
C.保持其他条件不变,升高温度,平衡时c(SO2)=0.0070 mol·L-1,则反应的H>0
D.相同温度下,起始时向容器中充入0.050 mol SO2和0.030 mol O2,达到平衡时SO2转化率大于88%
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中A、B、C、D分别代表有关反应中的一种化合物,其中物质A是一种高熔点化合物,
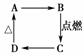
不溶于硫酸、硝酸,却溶于氢氟酸。请填写以下空白。
(1)A、B、C、D的化学式分别是________、________、________、________。
(2)A→B的化学方程式是____________________________________________。
(3)C→D的离子方程式是_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学平衡常数K的说法中,正确的是
A.K的大小与起始浓度有关
B.温度越高,K值越大
C.K值越大,反应正向进行的程度越大
D.K值越大,反应正向进行的程度越小
查看答案和解析>>
科目:高中化学 来源: 题型:
将纯水加热到较高温度,下列叙述正确的是
A.水的离子积变小,pH变大,呈碱性 B.水的离子积变大,pH变小,呈中性
C.水的离子积变大,pH变小,呈碱性 D.水的离子积不变,pH不变,呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时,① pH=2的CH3COOH溶液;② pH=2的HCl溶液;③ pH=12的氨水;④pH=12的NaOH溶液。相同条件下,有关上述溶液的比较中,不正确的是
A.由水电离的c(H+) :①=②=③=④
B.等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:②最大
C.将②、③溶液混合后,若pH=7,则消耗溶液的体积:②> ③
D.四种溶液均稀释100倍后,溶液的pH:③> ④> ②> ①
查看答案和解析>>
科目:高中化学 来源: 题型:
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。下列反应可制得ClO2:2KClO3+H2C2O4+H2SO4=lO2↑+K2SO4+2CO2↑+2H2O。下列判断正确的是 ( )
A. KClO3在反应中失去电子 B. H2C2O4是氧化剂
C. H2SO4发生氧化反应 D. 生成2 mol ClO2时有2 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.向盐酸中滴加氨水:H++OH-=H2O
B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O
C.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com