
| A. | 密度:四氯化碳>乙酸乙酯>水 | |
| B. | 沸点:乙醇>丙烷>乙烷 | |
| C. | 熔点:对二甲苯>邻二甲苯>间二甲苯 | |
| D. | 在水中的溶解度:丙三醇>苯酚>1-氯丁烷 |
分析 A.卤代烃的密度大于水的,酯的密度小于水的;
B.含有氢键的物质熔沸点较高,分子晶体熔沸点与其相对分子质量成正比;
C.二甲苯的结构越对称,其熔沸点越高;
D.含-OH越多,其溶解性越大,但卤代烃不溶于水.
解答 解:A.卤代烃的密度大于水的,酯的密度小于水的,所以密度四氯化碳>水>乙酸乙酯,故A错误;
B.含有氢键的物质熔沸点较高,分子晶体熔沸点与其相对分子质量成正比,乙醇中含有氢键,熔沸点最高,丙烷相对分子质量大于乙烷且二者都是分子晶体,所以熔沸点:乙醇>丙烷>乙烷,故B正确;
C.对二甲苯>间二甲苯>邻二甲苯对称性依次减弱,依据对称性越好沸点越低,则沸点从小到大顺序为:对二甲苯<间二甲苯<邻二甲苯,故C正确;
D.含-OH越多,溶解性越大,卤代烃不溶于水,则室温下,在水中的溶解度大小顺序是:丙三醇>苯酚>1-氯丁烷,故D正确;
故选A.
点评 本题考查物质溶解度、熔沸点、密度大小比较,明确分子晶体熔沸点与溶解性的影响因素是解本题关键,注意溶解性与-OH的关系,易错选项是D.


 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
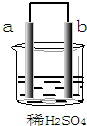
| A. | b极上发生了还原反应 | |
| B. | a是正极,b是负极 | |
| C. | a极上放出气体,溶液的pH增大 | |
| D. | 导线中有电子流动,电子从b极流到a极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na>S>O | B. | 酸性:H3PO4>H2SO4>HClO4 | ||
| C. | 热稳定性:HF>HCl>HBr | D. | 元素金属性:Na>Mg>Al |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | P、S、C1元素最高正价依次升高 | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 离子半径:Mg2+<Na+<F- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一元素不可能既有金属性,又有非金属性 | |
| B. | 某粒子${\;}_{z}^{A}$Rn+的核外电子数为Z+n | |
| C. | 41Ca与40Ca的失电子能力相同 | |
| D. | Cl?、S2?、Ca2+、K+半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com