
【题目】面对世界范围内的能源危机,甲醇作为一种可再生能源,有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:____
(2)对于CO(g)+2H2(g)CH3OH(g) ΔH1=-90 kJ·mol-1,在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时CO的转化率与温度、压强的关系如图所示。

①p1 _______(填“大于”“小于”或“等于”) p2。
②在其他条件不变的情况下,缩小体积使压强增大,达到新平衡时,CO的转化率________(填“增大”“减小”或“不变”),平衡常数________(填“增大”“减小”或“不变”)。
(3)已知在温度T时,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,判断此时刻υ正________(填“>” 、“=”或“<”)υ逆。
【答案】CO2(g) + 3H2(g)CH3OH(g)+ H2O(g) ΔH = -49kJ/mol 小于 增大 不变 >
【解析】
(1)根据盖斯定律和已知热化学方程式,可知二氧化碳、氢气制备甲醇的热化学方程式可由①-②得出;
(2)相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大;温度不变,则平衡常数不变;
(3)根据转化率计算各物质的浓度,进而计算Qc,与平衡常数相比较,可判断反应是否达到平衡状态,并判断反应的方向。
(1)已知式:①CO(g)+2H2(g) CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41 kJ·mol-1
根据盖斯定律将①-②得: CO2(g) + 3H2(g) CH3OH(g)+ H2O(g) ΔH = -49kJ/mol,
故答案为:CO2(g) + 3H2(g) CH3OH(g)+ H2O(g) ΔH = -49kJ/mol;
(2)①相同温度下,同一容器中,增大压强,平衡向正反应方向移动,CO的转化率增大,根据图象知,p1小于p2,故答案为:小于;
②在其它条件不变的情况下,缩小体积,增大压强,平衡向正反应方向移动,所以CO的转化率增大,由于反应的温度不变,则平衡常数不变,故答案为:增大,不变;
(3)某时刻经测定CO的转化率为10%,则:
CO(g) + H2O(g) CO2(g) + H2(g)
起始(mol/L): 1 1 0 0
转化(mol/I): 0.1 0.1 0.1 0.1
某时刻(mol/L):0.9 0.9 0.1 0.1
Qc=![]() =0.012<0.32,则没有达到平衡状态,反应向正反应方向移动,υ正>υ逆,故答案为:>;
=0.012<0.32,则没有达到平衡状态,反应向正反应方向移动,υ正>υ逆,故答案为:>;


科目:高中化学 来源: 题型:
【题目】随着科技进步和人类环保意识的增强,如何利用CO2已经成为世界各国特别关注的问题。
已知:CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
(1)降低温度,该反应速率会_______________(填“增大”或“减小”);一定压强下,由最稳定单质生1 mol化合物的焓变为该物质的摩尔生成焓。已知CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。则上述重整反应的ΔH=____________kJ/mol。
(2)T1℃时,在两个相同刚性密闭容器中充入CH4和CO2分压均为20 kPa,加入催化剂Ni/α-Al2O3并分别在T1℃和T2℃进行反应,测得CH4转化率随时间变化如图Ⅰ所示。

①A点处v正_______B点处(填“<”、“>”或“=”)
②研究表明CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A点处v生成(CO)=__________mol·g-1·s-1。
(3)上述反应达到平衡后,若改变某一条件,下列变化能说明平衡一定正向移动的是________________(填代号)。
A.正反应速率增大 B.生成物的百分含量增大 C.平衡常数K增大
(4)其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图Ⅱ,C点___________________(填“可能”、“一定”或“一定未”)达到平衡状态,理由是_____________;CH4的转化率b点高于a点的可能原因是_________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中互为同分异构体的有____,互为同素异形体的 有________,互为同位素的有________,是同一种物质的有________(填序号)。
(1)液氯 (2)氯气(3)白磷(4)红磷 (5)35Cl (6)37Cl
(7)![]() (8)
(8)![]() (9)CH2=CH-CH3 (10)
(9)CH2=CH-CH3 (10)![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
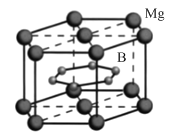
【题目】FeSe 、MgB2等超导材料具有广阔的应用前景。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态Se原子的电子占据最高能级的电子云轮廓图为________形。
(2)向FeSe中嵌入吡啶(![]() )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________;该分子内存在________(填标号)。
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________;该分子内存在________(填标号)。
A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为________。
②液氨是氨气液化的产物,氨气易液化的原因是________。
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为________。
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有________个与之等距离且最近的B原子;六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA ,该晶体的密度为________ g·cm-3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
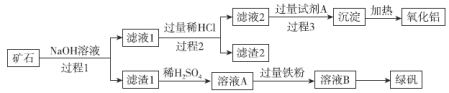
【题目】铝、铁、硅的单质及化合物在工业生产中具有广泛应用,工业上常用某矿石(主要成分有Al2O3、Fe2O3、FeO、SiO2等)来制备绿矾(FeSO4·7H2O)和氧化铝,其工艺流程如图:
回答下列问题:
(1)滤渣1的成分是___,举例说明滤渣2的用途___。
(2)用离子方程式表示溶液A加入过量铁粉的目的是___。
(3)写出由滤液1生成滤液2的离子方程式___。
(4)过程1、2、3均涉及分离操作,所需玻璃仪器有___。
(5)由溶液B得到绿矾的具体操作为___、过滤、洗涤和干燥。
(6)过程3需要加入的试剂A是___,写出此过程的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~D等几种烃分子的球棍模型如图所示,据此回答下列问题。
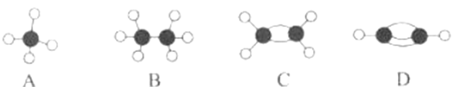
(1)D的分子式为__,A的二氯取代物有__种。
(2)分子中所有原子共平面的是__(填序号)。C可以通过加聚反应生成一种常见的高分子材料,写出该反应的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向质量为6.5g的Al和Fe的混合物中加入一定量稀HNO3恰使混合物完全溶解,放出NO(标准状况)2.24L,所得溶液中再滴加KSCN溶液,无红色出现。若用相同质量的上述混合物与足量的稀硫酸充分反应,所得到的气体在标准状况下的体积为( )
A.15.12LB.10.08LC.2.24LD.3.36L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锡酸钠用于制造陶瓷电容器的基体、颜料和催化剂。工业上以锡碲渣(主要含Na2SnO3和Na2TeO3)为原料,制备锡酸钠的工艺流程图如下,请回答下列问题:

已知:锡酸钠(Na2SnO3)和亚碲酸钠(Na2TeO3)均易溶于碱。
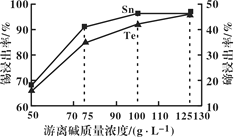
(1)“碱浸”过程中,锡碲浸出率与溶液中游离碱质量浓度关系如图所示,则最理想的质量浓度为__________,理由是______________。
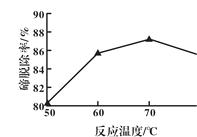
(2)如图反映的是“除碲”过程中反应温度对碲脱除率的影响关系,70℃后随温度升高碲脱除率下降的原因可能是______________。
(3)“除碲”反应的离子方程式为_________________。
(4)从“溶析结晶”回到“碱浸”的物质除烧碱外,主要还有_____________(写化学式)。
(5)“溶析结晶”母液中还含有少量SbO43-,可用锡片将Sb置换出来,锡转化成最高价含氧酸盐,写出反应的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用数字实验系统测定一定浓度碳酸钠溶液的pH与温度的关系,得到如图所示曲线。下列分析错误的是( )
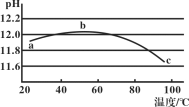
A.b点水解程度最大
B.水的电离平衡也会对溶液的pH产生影响
C.a→b段水解平衡向右移动
D.水解是吸热过程
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com