
【题目】根据要求完成下列各小题。
(1)由铜片、锌片和1L0.5mol/L的H2SO4(足量)组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36L(标准状况)的气体。请回答:
①负极是___(填“锌”或“铜”),发生___反应(填“氧化”或“还原”)。

②假设反应后溶液体积不变,反应后溶液的pH为___(用对数表示)。
(2)如图是某燃料电池的示意图,请回答:
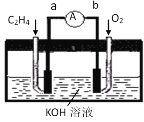
①在导线中电子流动方向为___(用a、b表示)。
②该燃料电池的负极反应式为___。
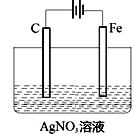
(3)如图是电解未知浓度的硝酸银溶液的示意图,请根据要求答题。
①Fe电极叫做___极,C电极的反应式为___。
②当某电极的固体质量增重21.6g时,整个装置共产生气体(标准状况下)体积2.24L,推断该气体的组成___(包括成分和体积)。
【答案】锌 氧化 1-lg7 a流向b(或a→b) C2H4 +16OH--12e-=2CO32-+10H2O 阴极 4OH--4e-=2H2O+O2 H2和O2;H2体积为0.747L O2体积为1.493L
【解析】
(1)①Zn、Cu、硫酸构成的原电池中,锌比铜活泼,据此分析判断;
②正极铜片上发生的电极反应为2H++2e-=H2↑,该气体为氢气,根据氢气的体积计算出反应的氢离子的物质的量,再计算溶液中剩余氢离子的物质的量和浓度,最后计算pH;
(2)在燃料电池中,通入燃料的为负极,通入氧气的为正极,据此分析解得;
(3)①根据图示,Fe电极连接电源的负极,为阴极,C电极为阳极,据此分析解得;②电解硝酸银溶液时,首先根据析出的银分析判断阴极上是否只有银离子放电,再根据得失电子守恒列式计算。
(1)①Zn、Cu、硫酸构成的原电池中,金属锌做负极,发生失电子的氧化反应,故答案为:锌;氧化;
②正极铜片上发生的电极反应为2H++2e-=H2↑,因此气体为氢气,物质的量=![]() =0.15mol,反应的H+为0.3mol,溶液中剩余氢离子1L×0.5mol/L×2-=0.3mol=0.7mol,c(H+)=
=0.15mol,反应的H+为0.3mol,溶液中剩余氢离子1L×0.5mol/L×2-=0.3mol=0.7mol,c(H+)=![]() =0.7mol/L,pH=- lg0.7=1-lg7,故答案为:1-lg7;
=0.7mol/L,pH=- lg0.7=1-lg7,故答案为:1-lg7;
(2)①在燃料电池中,通入燃料的为负极,通入氧气的为正极,所以导线中电子流动方向为由a到b,故答案为:a→b;
②在燃料电池中,通入燃料的为负极,负极上乙烯发生氧化反应生成碳酸根离子,电极反应式为C2H4 +16OH--12e-=2CO32-+10H2O,故答案为:C2H4 +16OH--12e-=2CO32-+10H2O;
(3)①根据图示,Fe电极连接电源的负极,为阴极,C电极为阳极,阳极上发生氧化反应,溶液中的氢氧根离子放电,电极反应式为4OH--4e-=2H2O+O2,故答案为:阴极;4OH--4e-=2H2O+O2;
②电解硝酸银溶液时,阴极上银离子放电生成银,Ag++e-= Ag,n(Ag)=![]() =0.2mol,转移0.2mol电子,阳极的反应式为4OH――4e-=2H2O+O2↑,因此生成的氧气为
=0.2mol,转移0.2mol电子,阳极的反应式为4OH――4e-=2H2O+O2↑,因此生成的氧气为![]() =0.05mol,标准状况下的体积0.05mol×22.4L/mol= 1.12L<2.24L,说明阴极上还生成了氢气,设生成氢气的物质的量为x,则阴极转移的电子为0.2mol+2x,则阳极放出的氧气为
=0.05mol,标准状况下的体积0.05mol×22.4L/mol= 1.12L<2.24L,说明阴极上还生成了氢气,设生成氢气的物质的量为x,则阴极转移的电子为0.2mol+2x,则阳极放出的氧气为![]() mol,因此
mol,因此![]() mol+x=
mol+x=![]() ,解得:x=
,解得:x=![]() mol,因此氢气的体积=
mol,因此氢气的体积=![]() mol×22.4L/mol= 0.747L,氧气的体积为2.24L-0.747L=1.493L,故答案为:H2体积为0.747L O2体积为1.493L。
mol×22.4L/mol= 0.747L,氧气的体积为2.24L-0.747L=1.493L,故答案为:H2体积为0.747L O2体积为1.493L。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器里,发生反应2A(g)+B(g)![]() 2C(g)。下列条件不能说明该反应达到平衡的是
2C(g)。下列条件不能说明该反应达到平衡的是
A.2υ正(B)=υ逆(C)
B.该体系的密度不随时间而变化
C.该体系的温度不随时间而变化
D.1molA的化学键断裂,同时1molC的化学键也断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A. pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1
B. pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C. pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+ c(H+)= c(OH-)+c( HC2O4-)
D. pH相同的①CH3COO Na②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式书写或离子共存说法正确的是( )
A.在0.1molL-1 Na2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存
B.常温下,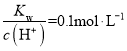 的溶液中,下列离子一定能大量共存:K+、Cl-、NO3-、Fe2+
的溶液中,下列离子一定能大量共存:K+、Cl-、NO3-、Fe2+
C.清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s) + CO32-(aq)![]() CaCO3(s) + SO42-(aq)
CaCO3(s) + SO42-(aq)
D.向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2+ + Al3+ + SO42- + OH- = BaSO4↓+ Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在固定容积、体积为2 L的密闭容器中充入1 mol N2和3 mol H2发生反应,当反应进行到10 s末时反应达到平衡,此时容器中c(NH3)=0.1mol·L-1。下列有关判断错误的是
A.反应达平衡时N2的转化率为10%
B.反应进行到10 s末时,H2的平均反应速率是0.03 mol·(L·s)-1
C.该反应达到平衡时,N2的平衡浓度为0.45 mol/L
D.该反应达到平衡时的压强是起始时压强的0.95倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=﹣Q1kJmol﹣1
2H2(g)+O2(g)=2H2O(g)ΔH=﹣Q2kJmol﹣1,
2H2(g)+O2(g)=2H2O(l) ΔH2=﹣Q3kJmol﹣1
常温下,取体积比2∶3的甲烷和氢气的混合气体11.2 L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1+0.15Q2B.0.2Q1+0.05Q2C.0.2Q1+0.15Q3D.0.2Q1+0.3Q2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含钴废催化剂(主要成分为Co、Fe、SiO2)为原料制取氧化钴(Co2O3)的流程如下:

(1)溶解Ⅰ:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是___________ 。所得滤渣的主要成分是___________ (写化学式)。
(2) 氧化:加热搅拌条件下加入NaClO3,将Fe2+氧化成Fe3+,其离子方程式____________ 。
(3) 某研究小组为测定黄钠铁矾[NaxFey(SO4)m(OH)n]的组成,进行了如下实验:
①称取4.850 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
②量取25.00 mL溶液A,加入足量的KI (反应为2Fe3++2I-=2Fe2++I2),用0.250 0 mol·L-1 Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3===2NaI+Na2S4O6),消耗30.00 mL Na2S2O3溶液至终点。
③另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥后,得沉淀1.165 g。通过计算确定黄钠铁矾的化学式(写出计算过程) ____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com