
【题目】工业上常用二氧化硫来漂白纸浆、丝毛、草帽等,此外二氧化硫还能够抑制霉菌和细菌的滋生,可以用作食物和干果的防腐剂。但必须严格按照国家有关范围和标准使用,我国规定葡萄酒中SO2的最大使用量为0.25g/L。某化学兴趣小组制备并对SO2的化学性质和用途进行探究,探究过程实验装置如下图,夹持仪器省略。
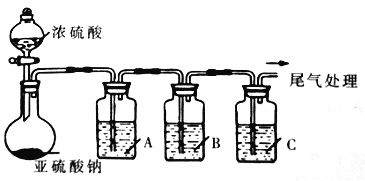
(1)实验可选用的实验试剂有浓硫酸、Na2SO3固体、Na2S溶液、BaCl2溶液、FeCl3溶液、品红溶液等。
①请完成下列表格
试剂 | 作用 | |
A | _______ | 验证SO2的还原性 |
B | Na2S溶液 | ___ |
C | 品红溶液 | ___ |
②A中发生反应的离子方程式为_______________________。
③在上述装置中通入过量的SO2,为了验证A中发生了氧化还原反应,取A中溶液分成两份,并设计了如下实验:
方案一:往第一份试液中加入少量酸化的KMnO4溶液,紫红色褪去。该方案是否合理________。(填“是”或“否”)
方案二:往第二份试液中加入K3[Fe(CN)6]溶液,实验现象为____________。
④该小组将SO2通入酸化的高锰酸钾溶液中,再向溶液中滴加氯化钡溶液,发现有白色沉淀生成,说明SO2具有还原性。该方案的不妥之处可能为_____________。
(2)该兴趣小组利用“直接碘量法”对葡萄酒中的SO2进行测量。取50.00ml葡萄酒样品于250ml碘量瓶中。加入少量碎冰块,再加入1ml淀粉指示液,10ml硫酸溶液,用浓度为cmol/L的碘标准滴定溶液迅速滴定至淡蓝色,保持30s不变即为终点,记下消耗碘标准滴定溶液的体积为Vml。以水代替样品,做空白试验,操作同上,空白试验消耗碘标准滴定溶液的体积为Voml。该葡萄酒中SO2含量计算式为___g/L。
【答案】 A.FeCl3溶液 B.验证SO2的氧化性 C.验证SO2的漂白性 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 否 特征的蓝色沉淀 高锰酸钾用硫酸酸化 
【解析】(1)①A装置中要验证SO2的还原性,需要选择氧化剂,而备选试剂中浓硫酸和FeCl3溶液是常见氧化剂,浓硫酸不能氧化SO2,故选择FeCl3溶液;B装置中盛有Na2S溶液,是常见还原性物质,与SO2发生氧化还原反应,可验证SO2的氧化性;SO2具有漂白性,可与 C装置中的品红溶液作用,使品红褪色。综上所述,答案为: A.FeCl3溶液 B.验证SO2的氧化性 C.验证SO2的漂白性 。②Fe3+和 SO2反应,![]() →
→![]() ,
,![]() →
→![]() ,根据得失电子守恒和电荷守恒还有参加反应,生成H+,离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 。③因为通入过量的SO2,SO2会和酸性KMnO4溶液反应,使酸性KMnO4溶液褪色,故不能验证A中发生了氧化还原反应,方案一答案为:否;往第二份试液中加入K3[Fe(CN)6]溶液,Fe2+与K3[Fe(CN)6]生成特征蓝色的铁氰化亚铁沉淀,故方案二现象为:生成特征的蓝色沉淀。④酸性高锰酸钾溶液是用硫酸酸化的,向溶液中滴加氯化钡溶液,即使SO2没有被氧化也会产生BaSO4白色沉淀,故该方案不妥之处为:高锰酸钾用硫酸酸化。
,根据得失电子守恒和电荷守恒还有参加反应,生成H+,离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 。③因为通入过量的SO2,SO2会和酸性KMnO4溶液反应,使酸性KMnO4溶液褪色,故不能验证A中发生了氧化还原反应,方案一答案为:否;往第二份试液中加入K3[Fe(CN)6]溶液,Fe2+与K3[Fe(CN)6]生成特征蓝色的铁氰化亚铁沉淀,故方案二现象为:生成特征的蓝色沉淀。④酸性高锰酸钾溶液是用硫酸酸化的,向溶液中滴加氯化钡溶液,即使SO2没有被氧化也会产生BaSO4白色沉淀,故该方案不妥之处为:高锰酸钾用硫酸酸化。
(2)根据化学方程式:I2+SO2+2H2O=2HI+H2SO4,可得关系:I2~SO2,由题意:n(SO2)=c×(VV0)×103mol,所以该葡萄酒中SO2含量为:c×(VV0)×103mol×64g/mol÷( 5×102L)=![]() g/L。
g/L。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,在体积为0.5 L的恒容密闭容器中,NO2和N2O4之间发生反应:2NO2 (g)(红棕色) ![]() N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。
N2O4 (g)(无色),反应过程中各物质的物质的量与时间的关系如图所示。

(1)曲线____(填“X”或“Y”)表示N2O4的物质的量随时间的变化曲线。
(2)在0~3 min内,用NO2表示的反应速率为____________。
(3)下列叙述能说明该反应已达到化学平衡状态的是________(填字母)。
a.容器内压强不再发生变化
b.NO2的体积分数不再发生变化
c.容器内原子总数不再发生变化
d.相同时间内消耗nmolN2O4的同时生成2nmol NO2
(4)反应达到平衡后,若降低温度,则v(正)______,v(逆)________。(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 在相同条件下PH=5的CH3COOH溶液和PH=5的NH4Cl溶液中,水的电离程度前者比后者大
B. 反应NH3(g)+HCl(g) ![]() NH4Cl(s)能自发进行,则该反应ΔH>0
NH4Cl(s)能自发进行,则该反应ΔH>0
C. 锌与稀硫酸反应时加入少量硫酸铜,反应加快的主要原因是Cu2+水解增大了c(H+)
D. 一定条件下,反应2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)<v逆(SO3)
2SO3(g) ΔH<0达到平衡后,升高体系温度,反应重新达到平衡前,有2v正(O2)<v逆(SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:
(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为______________,铜片周围溶液会出现___________的现象。
(2)若2 min后测得铁片和铜片之间的质量差为1.2g,计算:导线中流过的电子的物质的量为_________________mo1;
(3)金属的电化学腐蚀的本质是形成了原电池。如下图所示,烧杯中都盛有稀硫酸。


①图2 B中的Sn为________极,Sn极附近溶液的pH(填增大、减小或不变)___________。
②图2 C中被腐蚀的金属是___________。比较A、B、C中纯铁被腐蚀的速率由快到慢的顺序是______。
(4)人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:

①氢氧燃料电池的总反应化学方程式是:___________________。
②电池工作一段时间后硫酸溶液的浓度_____________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CaCO3(s)=CaO(s)+CO2(g)则该反应能自发进行的条件是( )
A.低温 B.高温
C.任何温度下都能自发进行 D.任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Sorbicillin (简称化合物X)是生产青霉素时的一个副产品,其结构简式如右下图所示。 下列有关化合物X的说法正确的是

A. 分子中所有碳原子可能处于同一平面
B. 1 mol化合物X可以与2 mol Na2CO3反应
C. 1mol化合物X可以与浓溴水发生取代反应消耗3molBr2
D. 化合物X与H2完全加成,每个产物分子中含有4个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是( )

A.E2表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的ΔH<0
D.加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室探究氨的有关性质,设计了下图所示实验,A处是气体发生装置,A中所用的实验药品从下列物质中选取。①碳酸钠 ②碳酸氢钠 ③碳酸氢铵 ④氯化铵 ⑤熟石灰 ⑥氢氧化钠

按上图连接好各仪器,先将C处的铂丝网加热至红热,再将A处产生的气体通过B装置片刻后撤去C处酒精灯,部分实验的现象如下:铂丝继续保持红热状态,D中的铜片慢慢溶解。回答下列问题:
(1)若A中制取气体时只用了一种药品,则该药品是___________(填物质序号)。
(2)B装置的作用为________________________;
(3)C中发生反应的方程式为________________________;
(4)图E中持续通入氧气的作用为_______________________;
(5)有人认为他们设计的这套实验装置还存在明显的不足,对其不足之处以及应如何改进,谈谈你的意见:______________。
(6)已知NH3难溶于CCl4,则下列装置中,不能用于吸收氨气的是(_____)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com