
分析 (1)处于中间价态的微粒既有氧化性又有还原性;
(2)至液体呈透明的红褐色得到的分散系为胶体;
(3)FeCl3溶液与铜反应生成氯化铜、氯化亚铁;取少量待测溶液,滴入KSCN溶液呈红色,则一定含铁离子;
(4)验证该溶液中含有Fe2+,利用其还原性,注意排除铁离子对亚铁离子检验的干扰;
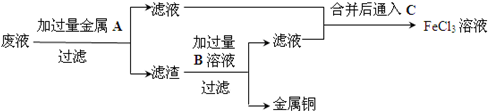
(5)腐蚀废液中含有氯化铜、氯化亚铁,加入过量的铁可以和氯化铜反应生成金属铜和氯化亚铁,故A为Fe,经过滤所得滤液是氯化亚铁,滤渣是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量B为盐酸可以将铜分离,得到的滤液为氯化亚铁,滤液合并后通入氯气,能将亚铁离子氧化为三价铁,以此解答该题.
解答 解:(1)A.Fe中Fe元素的化合价为最低价,只有还原性,故A不选;
B.FeCl3与D.Fe2O3中Fe元素的化合价为高价,只具有还原性,故BD不选;
C.FeSO4中Fe元素的化合价为+2价,为中间价态,既有氧化性又有还原性,故C选;
故答案为:C;
(2)向沸水中逐滴滴加1mol/L FeCl3溶液,至液体呈透明的红褐色,该分散系为胶体,可知粒子直径的范围是1~100nm,故答案为:1~100;)
(3)FeCl3溶液与铜反应生成氯化铜、氯化亚铁,离子反应为2Fe3++Cu=2Fe2++Cu2+,;取少量待测溶液,滴入KSCN溶液呈红色,则一定含铁离子,则Cu不足,溶液中还含Fe2+、Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;Fe3+、Fe2+、Cu2+;
(4)A.向试管中加入试液,滴入KSCN溶液,若显血红色,证明含有Fe3+,不能检验Fe2+,故A不选;
B.向试管中加入试液,滴入酸性高锰酸钾溶液,若褪色,发生氧化还原反应,体现Fe2+还原性,证明含有Fe2+,故B选;
C.向试管中加入试液,滴入氯水,可氧化亚铁离子,再滴入KSCN溶液,若显血红色,或原溶液中存在铁离子,则不能证明原溶液中含有Fe2+,故C不选;
故答案为:B;
(5)腐蚀废液中含有氯化铜、氯化亚铁,加入过量的铁可以和氯化铜反应生成金属铜和氯化亚铁,故A为Fe,经过滤所得滤液是氯化亚铁,滤渣是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量B为盐酸可以将铜分离,得到的滤液为氯化亚铁,滤液合并后通入氯气,能将亚铁离子氧化为三价铁,
①由上述分析可知,A为Fe,B为HCl,故答案为:Fe;HCl;
②C为氯气,通入C和氯化亚铁反应生成氯化铁,方程式为2FeCl2+Cl2=2FeCl3,故答案为:2FeCl2+Cl2=2FeCl3.
点评 本题考查较综合,涉及混合物分离提纯流程、氧化还原反应、离子检验等,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握物质的性质及反应原理,综合性较强,题目难度不大.


科目:高中化学 来源: 题型:解答题
 .
.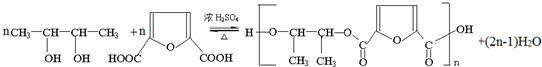 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 沉淀X的成分是SiO2、Fe2O3 | |
| B. | 从蛇纹石组成看,其成分皆是碱性氧化物 | |
| C. | 溶液Y中的阳离子主要是Mg2+、Al3+、Fe3+、H+ | |
| D. | 在溶液Y中加入过量的氨水,过滤得到的沉淀是Al(OH)3、Fe(OH)3和Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与过量稀硫酸反应:OH-+Ba2++SO42-+H+=BaSO4↓+H2O | |
| B. | 碳酸氢钙与过量的NaOH 溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| C. | 氯化铝溶液与过量的氨水反应:Al3++4OH-=AlO2-+2H2O | |
| D. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
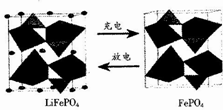 LiFePO4是锂离子电池一种电极材料,其结构稳定、资源丰富、安全性能好、无毒.该电极材料在充放电时的变化如图所示,下列有关说法正确的是( )
LiFePO4是锂离子电池一种电极材料,其结构稳定、资源丰富、安全性能好、无毒.该电极材料在充放电时的变化如图所示,下列有关说法正确的是( )| A. | 放电时该电极为负极 | |
| B. | 充电是Li+向阳极移动 | |
| C. | 充电时该电极发生氧化反应,反应式为LiFePO4-e-=FePO4+Li+ | |
| D. | 该电池可以用磷酸溶液作电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,浓硫酸能使铝钝化,可用铝制容器贮运浓硫酸 | |
| B. | 二氧化硅熔点很高、硬度很大,可用于制造坩埚 | |
| C. | 氯化铁溶液能腐蚀铜,可用于制作印刷电路板 | |
| D. | 金属钠硬度小、密度小,可用于制造高压钠灯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com