
| A. | 第17.18列元素都是非金属元素 | |
| B. | 第14列元素形成的化合物种类最多 | |
| C. | 第3列元素种类最多 | |
| D. | 只有第2列元素的原子最外层有2个电子 |
分析 在长式周期表中各族元素的排列顺序为:ⅠA、ⅡA、ⅢB-→ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA-→ⅦA、0族,18列元素应分别与以上各族对应.
A、根据第17、18列分别为卤族元素和稀有气体元素,全部为非金属元素;
B、根据第14列为碳族元素,形成化合物的种类最多;
C、根据第3列为ⅢB族,有镧系和锕系元素,元素种类最多;
D、根据元素He及多数过渡元素的最外层也是2个电子.
解答 解:在长式周期表中各族元素的排列顺序为:ⅠA、ⅡA、ⅢB-→ⅦB、Ⅷ、ⅠB、ⅡB、ⅢA-→ⅦA、0族,18列元素应分别与以上各族对应.
A、根据第17、18列分别为卤族元素和稀有气体元素,全部为非金属元素,故A正确;
B、第14列为碳族元素,形成化合物的种类最多,故B正确;
C、第3列为ⅢB族,有镧系和锕系元素,元素种类最多,故C正确;
D、第2列为碱土金属族,其最外层有2个电子,但元素He及多数过渡元素的最外层也是2个电子,故D错误;
故选:D.
点评 本题主要考查了长式周期表中各族元素的排列顺序,只要掌握了排列顺序即可完成,难度不大.


科目:高中化学 来源: 题型:解答题

 ;反应类型酯化反应会取代反应;
;反应类型酯化反应会取代反应;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 、C
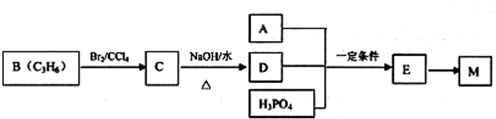
、C .反应④所用试剂和条件是氢氧化钠醇溶液、加热.
.反应④所用试剂和条件是氢氧化钠醇溶液、加热. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
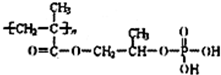
 ,该反应类型是酯化反应.
,该反应类型是酯化反应.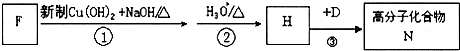
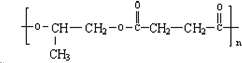
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
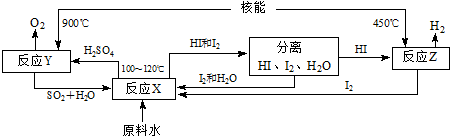
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com