
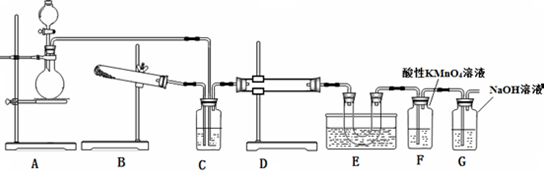
 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O
溴乙烷是一种重要的有机化工原料,其沸点为38.4℃.制备溴乙烷的一种方法是乙醇与氢溴酸、浓硫酸共热发生反应,该反应的化学方程式是CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O分析 制备溴乙烷的一种方法是乙醇与氢溴酸反应生成溴乙烷和水;
(1)长玻璃导管的作用是冷凝回流;
(2)溴单质溶解在有机物中显示棕黄色,溴单质可以和氢氧化钠发生反应;实现互不相溶液体的分离采用分液漏斗来分液;
(3)互相溶解的物质的分离采用蒸馏法;
(4)检验溴乙烷中含有溴元素一定要将之转化为溴离子,根据溴离子可以和银离子反应生成淡黄色不溶于硝酸的沉淀来检验.
解答 解:制备溴乙烷的一种方法是乙醇与氢溴酸反应生成溴乙烷和水,反应的化学方程式为:CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O,
故答案为:CH3CH2OH+HBr$→_{△}^{浓硫酸}$CH3CH2Br+H2O;
(1)实验时,长玻璃导管的作用是冷凝回流,可以获得要制取的有机物,故答案为:冷凝回流;
(2)溴单质溶解在有机物中显示棕黄色,为了除去粗产品中的杂质溴单质,可以用氢氧化钠来与之发生反应生成的溶液和溴乙烷互不相溶,实现溴乙烷和氯化钠、次溴酸钠水溶液的分离可以采用分液法,用分液漏斗来分液,
故答案为:a,分液漏斗;
(3)用蒸馏水洗涤,分液后,再加入无水CaCl2,溴乙烷的沸点较低,可以采用蒸馏来分离,
故答案为:b;
(4)为了检验溴乙烷中含有溴元素,不能直接向溴乙烷中滴加硝酸银溶液来检验,是因为溴乙烷中不含有溴离子;检验溴乙烷中含有溴元素一定要将之转化为溴离子,可以采用卤代烃的水解方法,即加入氢氧化钠即可,在溴离子可以和银离子反应生成淡黄色不溶于硝酸的沉淀溴化银来检验,可以加入硝酸酸化的硝酸银;
故答案为:④①③②.
点评 本题是一道考查溴乙烷的实验室制取的综合题,考查学生实验分析的能力,综合性较强,难度中等.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
下列装置或操作能达到实验目的的是

A.用装置甲制取氯气B.用乙装置除去氯气中的HCl气体
C.用丙装置萃取溴水中的溴单质D.用丁装置分离乙酸与乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙酸乙酯中少量的乙酸:加入少量乙醇,将其转化为乙酸乙酯 | |
| B. | 除去Fe(OH)3胶体中的NaCl:用水溶解后过滤 | |
| C. | 除去苯中的苯酚:加入浓溴水后过滤 | |
| D. | 除去溴乙烷中的溴:加入Na2S03溶液再分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com