
| R | ||
| X | T | Z |
| Q |
| A. | X的最高价氧化物能溶于强碱 | B. | 非金属性:T>R | ||
| C. | 单质导电性:Z>T>X | D. | R与Q的原子核外电子数相差16 |
分析 元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中只有X是短周期的金属元素,则X为Al元素,R为C元素,T为Si元素,Q为Ge元素,Z为P元素,然后结合元素周期律知识进行解答.
解答 解:元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示,其中只有X是短周期的金属元素,则X为Al元素,R为C元素,T为Si元素,Q为Ge元素,Z为P元素,
A.X为Al元素,氧化铝为两性氧化物,能溶于强碱,故A正确;
B.同主族从上到下非金属性依次减弱,则非金属性:T<R,故B错误;
C.X为Al、T为Si元素、Z为P元素,导电性最强的为X,Si为半导体材料,P不导电,故C错误;
D.R为C元素,Q为Ge元素,二者原子核外电子数相差26,故D错误;
故选A.
点评 本题考查原子结构与元素周期律的关系,题目难度不大,推断X为Al元素是解题的关键,注意掌握元素周期律内容、元素周期表结构,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电镀镍时,Ni为阴极,镀件为阳极 | |
| B. | 电镀和化学镀原理都是利用氧化还原反应 | |
| C. | 化学镀无需通电,对镀件的导电性无特殊要求 | |
| D. | 化学镀中H2PO2-中P化合价为+1,有强还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、Cu2+、Cl-、NO3- | B. | Na+、K+、SO32-、CO32- | ||
| C. | K+、HCO3-、NO3-、Cl- | D. | Ca2+、Mg2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 3种单体通过缩聚反应聚合 | B. | 形成该化合物的单体只有2种 | ||
| C. | 其中一种单体为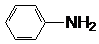 | D. | 其中一种单体为1,5-二甲基苯酚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与Fe(OH)3反应:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:填空题
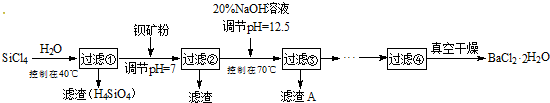
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com