
在下列条件下,两种气体的分子数一定相等的是
| A.同密度、同压强的N2和C2H4 | B.同温度、同体积的O2和N2 |
| C.同体积、同密度的C2H4和CO | D.同压强、同体积的O2和N2 |
科目:高中化学 来源:物理教研室 题型:021
|
|
X |
Y |
|
A |
温 度 |
混合气体平均相对分子质量 |
|
B |
压 强 |
B的浓度 |
|
C |
再 加 入 A |
B的转化率 |
|
D |
再 加 入 C |
A的质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
表一 原料、反应条件、平衡转化率、日产量
物质 项目 | 乙炔水化法 | 乙烯氧化法 |
原料 | 乙炔、水 | 乙烯、空气 |
反应条件 | HgSO4、100— | PdCl2—CuCl2、100— |
平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
日产量 | 2.5 t(某设备条件下) | 3.6 t(相同设备条件下) |
表二 原料来源生产工艺
反应过程 原料 | 原料生产工艺过程 |
乙炔 | CaCO3 |
乙烯 | 来源于石油裂解气 |
根据上述两表,完成下列问题:
(1)写出下列化学方程式。
a.乙炔水化法制乙醛:__________________。
b.乙烯氧化法制乙醛:__________________。
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法,可能的原因(从环境、原料来源、产率和产量、能耗等角度):_____________________________________________。
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?
(4)若将上述两种方法的反应条件,均增加“100 atm”,原料平衡转化率_______ (填“增大”“减小”或“不变”)。而实际生产中不采用,理由是____________________________。
(5)若乙烯由石油裂化气(裂化气混合气体的平均分子式CnHm,m>2n),进一步完全催化裂解而来,得到体积分数分别为:甲烷,5%;乙烯,40%;丙烯,10%。其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到40 mol乙烯,求能够得到丁二烯和氢气各多少摩尔(用m、n代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省定州中学高考复习综合测试化学试卷(带解析) 题型:计算题
(10分)工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法。下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一:原料、反应条件、平衡转化率、日产量
| | 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
| 平衡转化率 | 乙炔平衡转化率90%左右 | 乙烯平衡转化率80%左右 |
| 日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
| | 原料生产工艺过程 |
| 乙炔 | 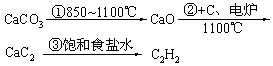 |
| 乙烯 | 来源于石油裂解气 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省高考复习综合测试化学试卷(解析版) 题型:计算题
(10分)工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法。下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一:原料、反应条件、平衡转化率、日产量
|
|
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空气 |
|
反应条件 |
HgSO4、100~125℃ |
PdCl2-CuCl2、100~125℃ |
|
平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
|
日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
表二:原料来源生产工艺
|
|
原料生产工艺过程 |
|
乙炔 |
|
|
乙烯 |
来源于石油裂解气 |
根据上述两表,回答下列问题:
(1)写出下列化学方程式:
a.乙炔水化法制乙醛__________________________________________________。
b.乙烯氧化法制乙醛______________________________________________。
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法(从环境、原料来源、产率和产量、能耗等角度),分析可能的原因:________________________________。
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?
___________________________________________________________________。
(4)若将上述两种方法的反应条件,均增加“100atm”,原料平衡转化率_______(填增大、减小、不变);而实际生产中不采用的理由是_____________________________。
(5)若乙烯由石油裂化(裂化气混合气体的平均化学式CnHm、m>2n),进一步完全催化裂解而来,得到体积百分含量分别为:甲烷:5%、乙烯:40%、丙烯:10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到40mol乙烯,求:能够得到丁二烯和氢气的物质的量各为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
表1 原料、反应条件、平衡转化率、日产量
| 乙炔水化法 | 乙烯氧化法 |
原料 | 乙炔、水 | 乙烯、空气 |
反应条件 | HgSO4、100~125℃ | PdCl2-CuCl2、100~125℃ |
平衡转化率 | 乙炔平衡转化率为90%左右 | 乙烯平衡转化率为80%左右 |
日产量 | 2.5吨(某设备条件下) | 3.6吨(相同设备条件下) |
表2 原料来源 生产工艺
| 原料生产工艺过程 |
乙炔 | CaCO3 |
乙烯 | 来源于石油裂解气 |
根据上述两表,回答下列问题:
(1)乙烯氧化法制乙醛的化学方程式是________________________________________。
(2)在相同条件下,两种制取乙醛的方法哪种快?_____________________________。现代工业上乙烯氧化法逐步取代乙炔水化法,请说出理由:___________________________(只需讲出两条)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com