
物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为
________________________________________________________________________
________________________________________________________________________。
(2)B为0.1 mol·L-1的NaHCO3溶液,NaHCO3在该溶液中存在的平衡有(用离子方程式表
示)________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(3)C为0.1 mol·L-1的(NH4)2Fe(SO4)2溶液,与同浓度的(NH4)2SO4溶液相比较____________(填溶质的化学式)溶液中NH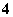 的浓度更大,其原因是
的浓度更大,其原因是
________________________________________________________________________
________________________________________________________________________。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在溶液中存在如下平衡:AgCl(s)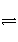
 Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
在25℃时,AgCl的Ksp=1.8×10-10 mol2·L-2。现将足量AgCl分别放入下列液体中:①100 mL蒸馏水
②100 mL 0.3 mol·L-1AgNO3溶液 ③100 mL 0.1 mol·L-1 MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为____________(填序号),此时溶液②中Cl-物质的量浓度为______________。
(1)[NH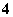 ]>[SO
]>[SO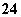 ]>[H+]>[OH-]
]>[H+]>[OH-]
(2)HCO
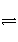
 H++CO
H++CO ;HCO
;HCO +H2O
+H2O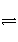
 H2CO3+OH-;H2O
H2CO3+OH-;H2O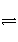
 H++OH-
H++OH-
(3)(NH4)2Fe(SO4)2 Fe2+水解显酸性,对NH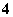 的水解有抑制作用
的水解有抑制作用
(4)②>①>③ 6×10-10 mol·L-1
解析 (1)NH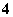 水解显酸性且水解程度小,所以有:
水解显酸性且水解程度小,所以有:
[NH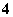 ]>[SO
]>[SO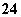 ]>[H+]>[OH-]。
]>[H+]>[OH-]。
(2)NaHCO3溶液中存在三个平衡体系:
①HCO 的电离平衡:HCO
的电离平衡:HCO
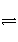
 H++CO
H++CO ;②HCO
;②HCO 的水解平衡:HCO
的水解平衡:HCO +H2O
+H2O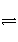
 H2CO3+OH-;③H2O的电离平衡:H2O
H2CO3+OH-;③H2O的电离平衡:H2O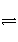
 H++OH-。
H++OH-。
(3)(NH4)2Fe(SO4)2溶液中,Fe2+水解产生的H+对NH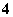 的水解起抑制作用,NH
的水解起抑制作用,NH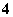 水解程度小,与同浓度的(NH4)2SO4溶液相比,前者NH
水解程度小,与同浓度的(NH4)2SO4溶液相比,前者NH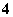 的浓度更大。
的浓度更大。
(4)①与③相比,③溶液中的Cl-使AgCl的溶解平衡逆向移动,[Ag+]最小,②中溶液中的Ag+虽然使AgCl的溶解平衡逆向移动,但溶液中Ag+的浓度要比①、③中Ag+的浓度大的多,所以②中Ag+浓度最大。②中[Cl-]=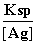 =
=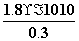 mol·L-1=6×10-10 mol·L
mol·L-1=6×10-10 mol·L


 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
由乙醇制乙二酸乙二酯最简单的正确流程途径顺序是( )
①取代反应 ②加成反应 ③氧化反应 ④还原反应 ⑤消去反应 ⑥酯化反应 ⑦水解反应
A.①②③⑤⑦ B.⑤②⑦③⑥
C.⑤②①③④ D.①②⑤③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中大量存在如下五种离子:NO3﹣、SO42﹣、Fe3+、H+、M,它们的物质的量之比依次为n(NO3﹣):n(SO42﹣):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能是( )
|
| A. | Al3+ | B. | Mg2+ | C. | CO32﹣ | D. | Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,某溶液中由水电离的[H+]=1×10-13 mol·L-1,该溶液可能是( )
①三氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
电离常数(Ka或Kb)、溶度积常数(Ksp)是判断物质性质的重要常数,下列关于这些常数的计算或运用正确的是( )
A.某亚硫酸溶液pH=4.3,若忽略二级电离,则其一级电离平衡常数K1=1.0×10-8.60 mol2·L-2
B.Ka(HCN)<Ka(CH3COOH),说明同浓度时氢氰酸的酸性比醋酸强
C.Ksp(AgI)<Ksp(AgCl),向AgCl悬浊液中加入KI溶液会出现黄色沉淀
D.Ksp(AgCl)<Ksp(AgOH),说明AgOH和AgCl均不溶于稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
铁粉可与高温水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32 g,则参加反应的铁粉的物质的量是( )
A.0.5 mol B.1 mol
C.1.5 mol D.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
将46 g金属钠和54 g金属铝同时放入足量的水中,最后得到5.0 L溶质仅为偏铝酸钠的溶液。计算:
(1)得到的气体在标准状况下的体积。
(2)所得溶液中偏铝酸钠的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示的装置进行实验:
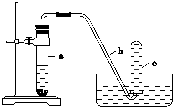
(1)在检查完装置的气密性后,向试管a中加入10 mL6 mol/L的稀HNO3和1 g Cu片,立即用带有导管的橡皮塞塞紧试管口,请写出在试管a中有可能发生的反应的化学方程式
_______________________________________________________________________________________________________________________________________________________________________________________________________________________。
(2)实验过程中常常反应开始时速率缓慢,随后逐渐加快,这是由于________________,当反应进行一段时间后速率又逐渐减慢,原因是________________________________________________________________________。
(3)欲较快地制得NO,可采取的措施是________。
A.加热 B.使用铜粉
C.稀释HNO3 D.改用浓HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
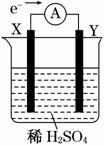
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为铁和碳棒,则X为碳棒,Y为铁
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com