
【题目】采用恰当的分离混合物的方法,下列做法中正确的是
A. 分离KNO3和碘的固体混合物:四氯化碳,分液
B. 除去AgI胶体中混有的I-离子:过滤、洗涤、干燥
C. 分离食用油和水:分液
D. 从溴水中分离溴:蒸馏
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体: Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
B. NaHCO3溶液与过量的Ba(OH)2溶液混合:2HCO3-+Ba2++2OH-══ BaCO3 ↓+2H2O+CO32-
C. 向FeBr2溶液中通入过量的Cl2:2Fe2++4Br-+3Cl2══ 2Fe3++2Br2+6Cl-
D. 向AlCl3溶液中滴加过量氨水: Al3++4NH3·H2O ══ AlO2-+4NH4++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】覆盆子酮(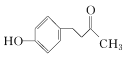 )是种从植物覆盆子中提取的较为安全的香料。一种以石油化工产A和丙烯为原料的合成路线如下:
)是种从植物覆盆子中提取的较为安全的香料。一种以石油化工产A和丙烯为原料的合成路线如下:
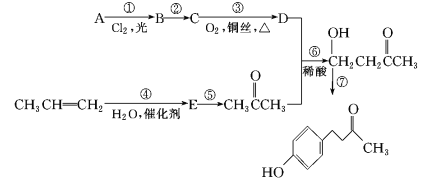
信息提示:
(ⅰ)
(ⅱ)![]()
![]()
根据上述信息回答:
(1)E的化学名称是__________。
(2)反应①的条件为____________________________。
(3)与反应⑥反应类型相同的是___________ (选填反应①~⑦, 下同),与反应③反应条件相似的是_____________。
(4)写出反应⑦的化学方程式_______________________________。
(5)E的同分异构体中,在核磁共振氢谱中出现三组峰,且峰面积之比为3∶3∶2的是___________(写出结构简式)。
(6)参照上述合成路线以丙烯为原料,设计制备CH3CH=CHCH2COCH3的合成路线_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,投入0.2mol N2和0.6 mol H2 ,发生可逆反应N2(g)+3H2(g)![]() 2NH3(g),2min后,生成0.04molNH3,下列说法中正确的是
2NH3(g),2min后,生成0.04molNH3,下列说法中正确的是
A. 2min内H2的反应速率为0.01mol·L-1·min-1
B. 若2min后,往容器中通入0.2mol的氩气,则生成NH3的反应速率加快
C. 若混合气体的密度不再改变,则反应达到平衡状态
D. 若单位时间内有3 mol H-H键断裂,同时就有6 mol N-H键断裂,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 此物质分子式为C5H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )
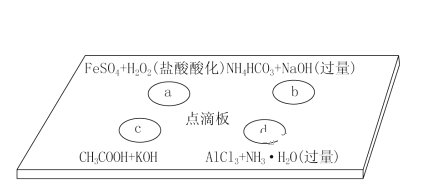
A. a反应:Fe2++2H++H2O2===Fe3++2H2O
B. b反应:HCO![]() +OH-===CO
+OH-===CO![]() +H2O
+H2O
C. c反应:H++OH-===H2O
D. d反应:Al3++3NH3·H2O===Al(OH)3↓+3NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表是ⅥA族部分元素的相关性质。
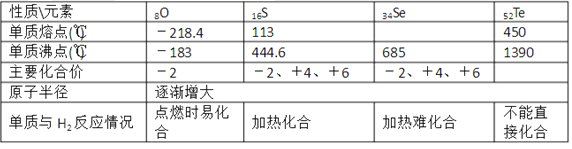
请回答下列问题:
(l)硒的熔点范围可能是____。
(2)碲的化合价可能有____。
(3)氢硒酸有较强的 ____填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生反应的化学方程式为____。
(4)工业上Al2Te可用来制备H2Te,完成下列化学方程式:___ Al2Te3+___ =2Al(OH)3↓+____H2Te↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.人体血液里Ca2+的浓度一般采用mg/cm3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
(配制KMnO4标准溶液)
如图所示是配制50 mL KMnO4标准溶液的过程示意图。

(1)请你观察图示判断,其中不正确的操作有__________ (填序号)。
(2)其中确定50 mL溶液体积的容器是________(填名称)。
(3)如果用图示的操作配制溶液,所配制的溶液浓度将________(填“偏大”或“偏小”)。
(测定血液样品中Ca2+的浓度)
抽取血样20.00 mL,经过上述处理后得到草酸,再用0.020 mol·L-1 KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00 mL KMnO4溶液。
(4)配平草酸与KMnO4反应的离子方程式:__MnO+ H2C2O4+ H+=== Mn2++ CO2↑+ H2O。
(5)滴定终点时的现象是_____________________________________
(6)经过计算,血液样品中Ca2+的浓度为__________m mol·cm-3。
Ⅱ. 某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应。
实验1试剂:酸化的0.5 mol·L-1FeSO4溶液(pH = 0.2),5% H2O2溶液(pH = 5)。
操作 | 现象 |
取2 mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡。测得反应后溶液pH=0.9 |
向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(1)H2O2的电子式是_______,上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是_________。
(2)产生气泡的原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一只量程为25 mL的滴定管,若液面在8.0 mL处,将溶液全部放下来,液体的体积为( )
A.17.00 mLB.大于17.00 mLC.小于17.00 mLD.无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com