
在一定条件下,使NO和O2在一密闭容器中进行可逆反应,下列说法中不正确的是
A. 反应开始时,正反应速率最大,逆反应速率为零
B. 随着反应进行,正反应速率逐渐减小,最后为零
C. 随着反应进行,逆反应速率逐渐增大,最后不变
D. 随着反应的进行,正反应速率逐渐减小,最后不变
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:2016届宁夏银川二中高三5月适应性训练理综化学试卷(解析版) 题型:选择题
X、Y、Z、W是原子序数依次增大的四种短周期元素,已知X、Z,Y、W分别位于同一主族,X与Z形成的离子化合物能与X、Y形成的常见液态共价化合物反应生成X2单质,Y、W两元素可形成两种常见的化合物,以下说法正确的是
A.X、Y、Z、W四种元素形成的化合物,其水溶液一定显强酸性
B.Y、W的氢化物的稳定性后者强于前者
C.X、Y、Z、W形成的简单离子半径大小依次增大
D.Z的单质可与X、Y形成的共价化合物反应生成X2单质
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三高考前模拟理综化学试卷(解析版) 题型:填空题
乙苯是一种用途广泛的有机原料,可制备多种化工产品。
(一)制备苯乙烯(原理如反应I所示):

(1)部分化学键的键能如下表所示:

根据反应I的能量变化,计算x= ____。
(2)工业上,在恒压设备中进行反应I时,常在乙苯蒸气中通入一定量的水蒸气。用化学平衡理论解释通入水蒸气的原因为____ 。
(3)从体系自由能变化的角度分析,反应I在____(填“高温”或“低温”)下有利于其自发进行。
(二)制备α-氯乙基苯(原理如反应II所示):

(4)T℃时,向10 L恒容密闭容器中充人2mol乙苯(g)和2 mol Cl2(g)发生反应Ⅱ,5 min时达到平衡,乙苯和Cl2、α-氯乙基苯和HCl的物质的量浓度(c)随时间(t)变化的曲线如图l所示:
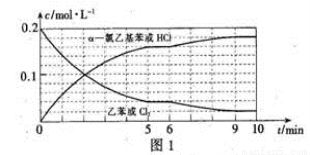
①0—5 min内,以HCl表示的该反应速率v(HCl)=_____________。
②T℃时,该反应的平衡常数K=_____________。
③6 min时,改变的外界条件为_____________。
④10 min时,保持其他条件不变,再向容器中充人1moI乙苯、1 mol Cl2、1 mol α-氯乙基苯和l mol HCl,12 min时达到新平衡。在图2中画出10-12 min,Cl2和HCl的浓度变化曲线(曲线上标明Cl2和HC1);0—5 min和0—12 min时间段,Cl2的转化率分别用α1、α2表示,则αl α2(填“>”、“<”或“=”)。

查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市高三高考前最后一卷理综化学试卷(解析版) 题型:选择题
用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。下列有关叙述不正确的是
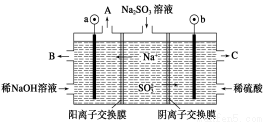
A.图中a极连接电源的负极
B.A口放出的物质是氢气,C口放出的物质是氧气
C.b极电极反应式为:SO32--2e-+H2O===SO42-+2H+
D.电解过程中阴极区碱性明显增强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下第二次段考化学卷(解析版) 题型:实验题
某化学课外小组通过实验探究化学反应速率和化学反应限度。
(1)实验一:探究温度和浓度对反应速率的影响
方案:在酸性溶液中,碘酸钾( KIO3)和亚硫酸钠可发生反应生成碘(2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O),生成的碘可用淀粉溶液检验,根据出现蓝色所需的 时间来衡量该反应的速率。
实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
① | 5 | 5 | V1 | 0 | |
② | 5 | 5 | 40 | 25 | |
③ | 5 | V2 | 35 | 25 |
则V1= mL,V2= mL.
(2)实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度。
实验步骤:
ⅰ.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
①写出KI和FeCl3反应的离子方程式: 。
②步骤ⅲ中,试剂X是 。
③步骤ⅱ和ⅲ中的实验现象说明KI和FeCl3混合时生成KCI、I2和FeCl2的反应存在一定的限度,该实验现象是:
ⅱ中 。
ⅲ中 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下第二次段考化学卷(解析版) 题型:选择题
已知:(1)Zn(s)+1/2O2(g)= Z nO(s), ΔH=-348.3kJ/mol
nO(s), ΔH=-348.3kJ/mol
(2)2Ag(s)+1/2 O2(g)= Ag2O(s), ΔH=-31.0kJ/mol
则Zn(s)+ Ag2O(s)= ZnO(s)+ 2Ag(s)的ΔH等于
2Ag(s)的ΔH等于
A. -317.3kJ/mol B. -379.3kJ/mol C. -332.8 kJ/mol D. +317.3 kJ/mo l
l
查看答案和解析>>
科目:高中化学 来源:2016届江苏省等三校高三第四次模拟化学试卷(解析版) 题型:填空题
【物质结构与性质】纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色。
(1)写出基态Cu+的核外电子排布式____________;
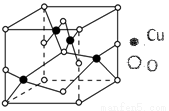
(2)如图结构是铜的某氧化物的晶体结构的最小重复单元,则该氧化物的化学式为____________;
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4•H2O沉淀。
①该沉淀中S原子的杂化类型为____________;
②写出一种与NH3分子互为等电子体的阳离子的化学式____________。
(4)NH3的沸点高于PH3,原因是____________
(5)CuO的熔点比CuCl的熔点____________(填“高”或“低”),其原因是____________。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省等三校高三第四次模拟化学试卷(解析版) 题型:选择题
下列有关物质的性质或应用均正确的是
A.二氧化硅为酸性氧化物,可用于制做计算机芯片
B.铜的金属活泼性比铁差,可在海轮外壳上装若干铜块以减缓其腐蚀
C.Zn具有还原性和导电性,可用作锌锰干电池的负极材料
D.浓硫酸具有脱水性,可用于干燥NH3、SO2等
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三高考打靶测试理综化学试卷(解析版) 题型:推断题
【化学选修5:有机化学基础】化合物X是一种环境激素,存在如下转化有关系:
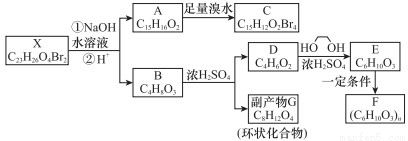
已知:①1H-NMR谱显示化合物G的所有氢原子化学环境相同;
②F是一种可用于制备隐形眼镜的高聚物。
根据以上信息回答下列问题
(1)化合物X的分子所含官能团的名称___________________________________;
(2)化合物C的分子式是___________,A→C的反应类型是_______________;
(3)化合物D的名称是________________;同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构)_________有种;
a.属于酯类 b.能发生银镜反应
其中的一个同分异构体核磁共振氢谱为三组峰,且峰的面积比为1:2:3,写出这种同分异构体的结构简式____________________;
(4)写出B→G反应的化学方程式____________________;
(5)写出F的结构简式____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com