
| 实验装置 | 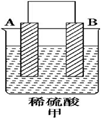 |  | 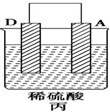 |
| 部分实验现象 | A(二价金属)不断溶解 | C的质量增加 | A上有气体产生 |
分析 (1)甲装置中,二价金属A不断溶解说明该装置构成了原电池,且A失电子发生氧化反应而作负极,B作正极;乙中C的质量增加,说明C上铜离子得电子发生还原反应,则C作原电池正极,B作负极;丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应,则A作原电池正极,D作负极,作原电池负极的金属活动性大于作正极金属,所以金属活动性强弱顺序是:D>A>B>C;
(2)A、改变体积达到新的平衡时,SO3、O2的物质的量分别为1.4mol和0.8mol,说明缩小体积平衡向正反应方向移动,
设改变体积后生成的SO3的物质的量为xmol,则:
2SO2(g)+O2(g)?2SO3(g)
xmol 0.5xmol xmol
故(1.4mol-xmol):(0.8mol+0.5xmol)=4:3,解得x=0.2,
故原平衡时SO3的物质的量=1.4mol-0.2mol=1.2mol,
则原平衡时SO2的物质的量=1.2mol×$\frac{1}{2}$=0.6mol,
故到达新平衡SO2的物质的量=0.6mol-0.2mol=0.4mol;
B、由A知生成的SO3的物质的量为0.2mol,所以缩小体积,再次达到平衡过程中,v正>v逆;
C.使用催化剂加快化学反应速率,所以对化学反应速率影响很大;
D.工业上一般采用增加O2的浓度,平衡正向移动,二氧化硫转化率增大.
解答 解:(1)①该装置中,二价金属A不断溶解说明A失电子发生氧化反应生成金属阳离子进入溶液而作负极,所以负极电极反应式为A-2e-═A2+,
故答案为:A-2e-═A2+;
②乙装置中,C的质量增加说明C电极上铜离子得电子发生还原反应,则C作正极,电极反应式为Cu2++2e-═Cu,
故答案为:Cu2++2e-═Cu;
③丙装置中A上有气体产生,说明A上氢离子得电子发生还原反应而作正极,D作负极,正极上氢离子逐渐析出而导致氢离子浓度逐渐减小,则溶液的pH逐渐增大,
故答案为:增大;
④通过以上分析知,四种金属活动性强弱顺序是D>A>B>C,
故答案为:D>A>B>C;
(2)A、改变体积达到新的平衡时,SO3、O2的物质的量分别为1.4mol和0.8mol,说明缩小体积平衡向正反应方向移动,
设改变体积后生成的SO3的物质的量为xmol,则:
2SO2(g)+O2(g)?2SO3(g)
xmol 0.5xmol xmol
故(1.4mol-xmol):(0.8mol+0.5xmol)=4:3,解得x=0.2,
故原平衡时SO3的物质的量=1.4mol-0.2mol=1.2mol,
则原平衡时SO2的物质的量=1.2mol×$\frac{1}{2}$=0.6mol,
故到达新平衡SO2的物质的量=0.6mol-0.2mol=0.4mol,所以再次达到平衡状态时,n(SO2)为0.4mol,故A正确;
B、由A知生成的SO3的物质的量为0.2mol,所以缩小体积,再次达到平衡过程中,v正>v逆,故B正确;
C.使用催化剂加快化学反应速率,所以对化学反应速率影响很大,而不是不大,故C错误;
D.工业上一般采用增加O2的浓度,平衡正向移动,二氧化硫转化率增大,而不是提高氧气的转化率,故D错误;
故选AB.
点评 本题考查了原电池原理,根据原电池电极上得失电子来判断正负极,一般来说,作原电池负极的金属金属活动性顺序强,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm互为同位素 | |
| B. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm的质量数相同 | |
| C. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm是同一种核素 | |
| D. | ${\;}_{62}^{144}$Sm与${\;}_{62}^{150}$Sm是不同元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时溶液中的H+向负极移动 | |
| B. | 在放电时,正极发生的反应是 Pb(s)+SO42-(aq)=PbSO4(s)+2e- | |
| C. | 在放电时,该电池的负极材料是铅板 | |
| D. | 放电时负极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 W、X、Y、Z、M、G五种短周期元素,原子序数依次增大.W,Z同主族,可形成离子化合物ZW;Y,M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性.
W、X、Y、Z、M、G五种短周期元素,原子序数依次增大.W,Z同主族,可形成离子化合物ZW;Y,M同主族,可形成MY2,MY3两种分子;X的气态氢化物水溶液呈碱性.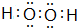 ,用电子式表示Z2M的形成过程:
,用电子式表示Z2M的形成过程: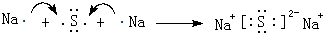 .
.| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,由水电离出的c(H+)=10-12mol/L,则溶液pH一定为12 | |
| B. | 已知H2C2O4是弱酸,其电离方程式为:H2C2O4?2H++C2O42- | |
| C. | 常温下,pH=10的氨水溶液中,由水电离出的c(H+)=10-10mol/L | |
| D. | 工业合成氨温度控制在500℃,目的是为了提高产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | O=O | H-O |
| 键能kJ•mol-1 | 436 | 496 | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
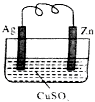 如图所示的原电池,一段时间后某极析出6.4克的固体.回答下列问题:
如图所示的原电池,一段时间后某极析出6.4克的固体.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com