
| A. | ①AgNO3;②NaBr;③AgBr | B. | ①AgNO3;②NaCl;③AgCl | ||
| C. | ①AgCl; ②AgNO3;③NaCl | D. | ①AgNO3;②NaCl;③Ag |
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 所有主族元素的最高正化合价都等于其最外层电子数 | |
| B. | 所有过渡元素都是金属元素,所有的金属元素也都是过渡元素 | |
| C. | 在周期表中氧族元素的单质全部是气体 | |
| D. | 同周期主族元素的原子半径以ⅦA族的为最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
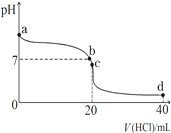 (1)明矾可用于净水,用离子方程式解释其原因Al3++3H2O?Al(OH)3(胶体)+3H+.把FeCl3溶液蒸干、灼烧、最后得到的主要固体产物是Fe2O3.
(1)明矾可用于净水,用离子方程式解释其原因Al3++3H2O?Al(OH)3(胶体)+3H+.把FeCl3溶液蒸干、灼烧、最后得到的主要固体产物是Fe2O3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
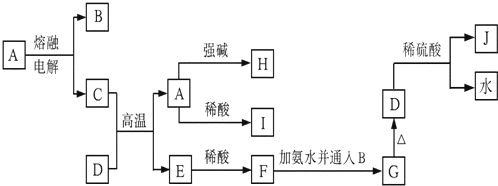
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
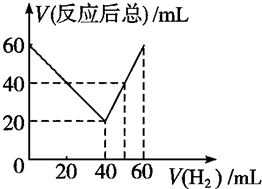 某气态不饱和链烃CnHm在一定条件下与H2加成为CnHm+x,取CnHm和H2混合气体共60mL进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积数也不同,反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温同压下测定).由此可知x的数值为( )
某气态不饱和链烃CnHm在一定条件下与H2加成为CnHm+x,取CnHm和H2混合气体共60mL进行实验,发现随混合气中H2所占体积的变化,反应后得到的气体总体积数也不同,反应前混合气体中H2所占的体积V(H2)和反应后气体总体积V(反应后总)的关系如图所示(气体体积均在同温同压下测定).由此可知x的数值为( )| A. | 4 | B. | 3 | C. | 2 | D. | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极反应为:Zn-2e-+2OH--Zn(OH)2 | |
| B. | 放电时正极发生氧化反应 | |
| C. | 放电时每转移2mol电子,反应的锌的质量是65g | |
| D. | 放电时化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层电子数是次外层电子数2倍的元素 | |
| B. | 原子M层电子数等于L层和K层电子数之差的元素 | |
| C. | 第三周期ⅦA族的元素 | |
| D. | 最高正价和最低负价的绝对值之差为2的元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com