
| A. | 只有②④⑥ | B. | 只有①⑤⑥ | C. | 只有②③④ | D. | 只有③⑤⑦ |
分析 ①元素的非金属性越强,其氢化物越稳定;
②根据分散系中的分散质来分析;
③ⅠA、ⅡA族元素的原子失掉最外层电子形成阳离子;
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素,为过渡元素;
⑤同位素质子数相同、中子数不同;
⑥1mol物质完全燃烧生成稳定氧化物放出的热量为其燃烧热;
⑦白磷的着火点低,能自燃,氮气中的化学键键能大,则稳定,但非金属性N>P.
解答 解:①元素的非金属性越强,其氢化物越稳定,非金属性F>O>S,所以氢化物的稳定性HF>H2O>H2S,故错误;
②泥水中分散质>100nm,盐酸中<1nm,淀粉溶液中1nm~100nm,则水、淀粉溶液、盐酸分别属于悬浊液、胶体、溶液,故正确;
③H+最外层没有电子,其它ⅠA、ⅡA族元素的阳离子比同周期稀有气体元素的原子的核外电子排布少一个电子层,所以ⅠA、ⅡA族元素的阳离子与上一周期稀有气体元素的原子具有相同的核外电子排布(氢元素除外),故错误;
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素,为过渡元素,故正确;
⑤同位素质子数相同而中子数不同,第IA族元素铯的两种同位素137Cs比133Cs质子数相同,而中子数前者比后者多4个,故错误;
⑥1mol物质完全燃烧生成稳定氧化物放出的热量为其燃烧热,所以2H2(g)+O2(g)=2H2O(l)△H=-571kJ•mol-1则氢气的燃烧热为△H=-285.5kJ•mol-1,故正确;
⑦不能利用单质的性质来比较非金属性的强弱,非金属性N>P,故错误;
故选A.
点评 本题考查较综合,涉及原子结构、非金属性强弱判断、燃烧热、元素周期表结构等知识点,明确原子结构、物质结构、基本概念及基本理论是解本题关键,易错选项是⑦.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
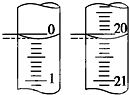 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液.| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.20 | 20.22 | |
| 第二次 | 25.00 | 0.56 | 24.54 | |
| 第三次 | 25.00 | 0.42 | 20.40 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
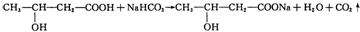 .
. .
.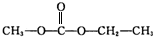 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢燃料电池汽车的使用可以有效减少城市空气污染 | |
| B. | 电解水制取氢气是理想而经济的制氢方法 | |
| C. | 发展氢燃料电池汽车不需要安全高效的储氢技术 | |
| D. | 氢燃料电池把氢气和氧气燃烧放出的热能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成; ②球棍模型为: 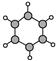 |
| C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. |
| D | ①相对分子质量比C少2; ②能由C氧化而成; |
| E | ①由C、H、O三种元素组成; ②球棍模型为: 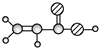 |
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键就是使阴、阳离子结合成化合物的静电引力 | |
| B. | 在化合物Na2O2中,阴、阳离子的个数比为1:1 | |
| C. | 在化合物CaCl2中,两个氯离子之间存在共价键 | |
| D. | 液态HCl不能导电,属于共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com