
| X | Y | Z | 目的 | 装置 | |
| A | 甲苯 | KMnO4溶液 | 稀硫酸 | 证明甲基对苯环的性质存在影响 | 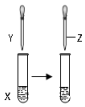 |
| B | FeCl3溶液 | KSCN溶液 | 饱和KCl溶液 | 证明增大反应物浓度化学平衡向正反应方向移动 | |
| C | 1mol/LNaOH 溶液5mL | 1-氯丁烷5mL | 2%AgNO3 溶液1mL | 证明1-氯丁烷中含有氯元素 | |
| D | 0.1mol/LNaCl 溶液2mL | 0.1mol/LAgNO3溶液1mL | 0.1mol/LNa2S 溶液1mL | 证明AgCl大于Ag2S的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯环影响甲基,被高锰酸钾氧化生成苯甲酸;
B.KCl对络合反应无影响;
C.水解后检验卤素离子,应在酸性条件下;
D.生成AgCl转化为硫化银,为沉淀的转化.
解答 解:A.苯环影响甲基,被高锰酸钾氧化生成苯甲酸,不能验证实验目的,故A错误;
B.KCl对络合反应无影响,则不能说明平衡移动,故B错误;
C.水解后检验卤素离子,应在酸性条件下,没有加酸至酸性,不能检验氯离子,故C错误;
D.生成AgCl转化为硫化银,为沉淀的转化,可证明AgCl大于Ag2S的溶解度,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握有机物的性质、化学平衡、离子检验、沉淀转化为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用风能、太阳能等清洁能源代替化石燃料,可减少环境污染 | |
| B. | 煤的干馏、煤的汽化和煤的液化都属于化学变化 | |
| C. | 自来水厂用明矾净水,用Fe2(SO4)3或ClO2代替明矾净水,其原理相同 | |
| D. | 将水中的铁闸门连接电源的负极而防腐,是外加电流的阴极保护法 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
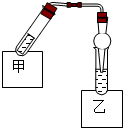 如图是乙酸乙酯制备的装置.在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上.
如图是乙酸乙酯制备的装置.在试管甲中先加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸钠,用玻璃棒充分搅拌后将试管固定在铁架台上.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol的  与足量的NaOH溶液反应,能消耗3mol NaOH 与足量的NaOH溶液反应,能消耗3mol NaOH | |
| B. | 可用氢氧化钠溶液除去乙酸乙酯中残留的乙酸 | |
| C. | 间二甲苯也叫1,5-二甲苯 | |
| D. | 乙二醇和丙三醇互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe3+ | Ni2+ | Cr3+ | |
| 开始沉淀 | 1.5 | 6.7 | 4.0 |
| 沉淀完全 | 3.4 | 9.5 | 6.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )是一种定香剂,以芳香醇A为原料合成H的一种流程如图:
)是一种定香剂,以芳香醇A为原料合成H的一种流程如图:
 +H2O(R1、R表示氢原子或烃基)
+H2O(R1、R表示氢原子或烃基) ;H的官能团名称是碳碳双键、酯基.
;H的官能团名称是碳碳双键、酯基. .
. (写一种即可).
(写一种即可).查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 金属钠和水反应 | B. | 生石灰变成熟石灰的反应 | ||
| C. | Al和Fe2O3的铝热反应 | D. | CaCO3受热分解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com