
| 6.72L |
| 22.4L/mol |
| 3.6g |
| 18g/mol |
| 12.0g-12g/mol×0.3mol-1g/mol×0.4mol |
| 16g/mol |
| 9.2g |
| 46g/mol |
| 3.36L |
| 22.4L/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 分子筛具有均匀的微孔结构,分子筛筛分作用见图.
分子筛具有均匀的微孔结构,分子筛筛分作用见图.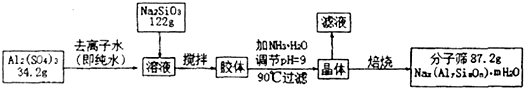
| ? |
| A |
| ? |
| A |
| ? |
| A |
| ? |
| A |
查看答案和解析>>
科目:高中化学 来源: 题型:
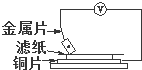 将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如右图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如右图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:| 金属 | 电流方向 | 电压/V |
| A | Cu→A | +0.78 |
| B | B→Cu | -0.30 |
| C | Cu→C | +1.35 |
| D | Cu→D | +0.15 |
| A、金属性由强到弱的顺序为:C>A>B>D |
| B、金属B不能从CuSO4溶液中置换出单质铜 |
| C、放金属C时铜片上发生的反应为:Cu-2e-=Cu2+ |
| D、金属D表面反应为:O2+2H2O+4e-=4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
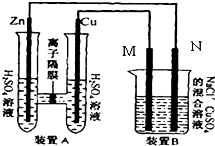 如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加
如图装置B中是浓度均为0.1mol/L的NaCl、CuSO4混合溶液,溶液体积为500ml,M、N均为石墨电极,当装置A中Zn棒质量减少6.5g时,N上质量增加查看答案和解析>>
科目:高中化学 来源: 题型:
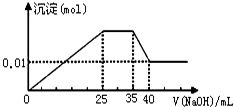 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:| 离子 | H+ | NH4+ | K+ | Mg2+ | Cu2+ | Al3+ |
| c/mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C5H12O3 |
| B、C4H10 |
| C、C6H10O4 |
| D、C5H10O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、血红蛋白、牛胰岛素、蚕丝、人造奶油充分水解后均可得到氨基酸 |
| B、李比希燃烧法、钠熔法、铜丝燃烧法、纸层析法都是元素定性分析法 |
| C、测定有机物结构方法较多,如红外光谱、紫外光谱、质谱、核磁共振谱、同位素示踪法等 |
| D、色谱法通常用于分离结构相近、物理性质和化学性质相似的物质.纸层析法就是一种简单的色谱分析法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mo1?L-1稀硫酸100mL中含有硫酸根的个数为0.1NA | ||
B、1 cm3铁所含的铁原子数是
| ||
| C、常温下,2.7g 铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA | ||
| D、2.24L CO2与足量的Na2O2转移的电子总数可能为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com