
| A. | 有机物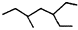 的系统命名为:3-乙基-5-甲基庚烷 的系统命名为:3-乙基-5-甲基庚烷 | |
| B. | 用Na2CO3溶液能区分CH3COOH、CH3CH2OH、苯、硝基苯四种物质 | |
| C. | 等质量的丁烷、丁烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次增加 | |
| D. | 糖类、油脂、蛋白质都属于天然有机高分子化合物,都能发生水解反应 |
分析 A.烃基的编号错误;
B.CH3COOH可与碳酸钠反应,CH3CH2OH溶于水,C6H6、C6H5NO2都不溶于水,但密度大小不同;
C.等质量的烃,含氢量越高耗氧量越高;
D.油脂、单糖、二糖不是高分子化合物.
解答 解:A.烃基的编号错误,应为3-甲基-5-乙基庚烷,故A错误;
B.碳酸钠与乙酸能反应生成二氧化碳,和乙醇溶液能互溶,和苯混合后不反应,但油状液体在上层,和硝基苯不反应,但油状液体在下层,故能鉴别开,故B正确;
C.烃中含氢量越大,质量不变时消耗的氧气的量越大,等质量的丁烷、丁烯、1,3-丁二烯分别充分燃烧,所耗氧气的量依次减少,故C错误;
D.高分子化合物的相对分子质量在10000以上,油脂、单糖、二糖不是高分子化合物,故D错误.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的组成、结构和性质,难度不大,注意相关基础知识的积累.


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:解答题

| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| 电负性值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
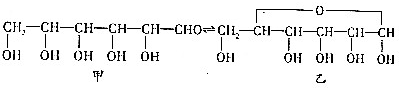
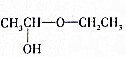 试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→
试写出由两种简单的有机物合成该烃基醚的化学方程式:CH3CHO+CH3CH2OH→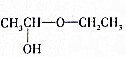 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
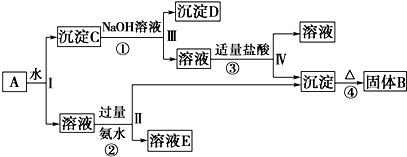
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
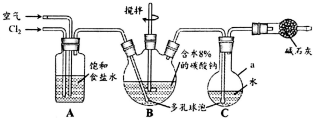 次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.
次氯酸(HClO)仅存在于溶液中,有很强的氧化性和漂白作用.某兴趣小组拟用Cl2O与潮湿Na2CO3反应制得Cl2O,再用水吸收Cl2O制备次氯酸溶液,并测定其浓度.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | 25℃时,PH=1的醋酸溶液中含有H+的数目小于0.1NA | |
| C. | 在NaHS溶液中滴入CuCl2溶液产生黑色沉淀,HS-水解程度增,pH增大 | |
| D. | 3种pH相同的溶液①CH3COONa ②NaHCO3 ③NaOH中c(Na+)的大小是①>②>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的名称可能为 2-甲基-5-乙基己烷 | |
| B. | 苯的四氯代物共有三种不同的结构 | |
| C. | 等物质的量的乙烯与碳酸二甲酯(CH3OCOOCH3)完全燃烧的耗氧量不同 | |
| D. | 同为高分子化合物的淀粉、植物油和蛋白质,其水解产物中均含氧元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
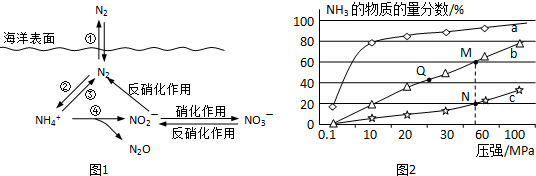
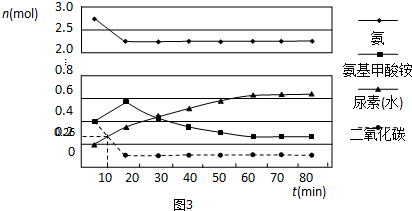
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com