
分析 (1)氧化铜和氢气反应生成铜和氧化亚铜、水,所以固体减少的质量为氧元素的质量,根据剩余氧元素的质量计算氧化亚铜的物质的量,再根据元素守恒计算铜的物质的量.
(2)根据铜的物质的量计算铜的质量,从而得出氧化亚铜的质量,再根据反应方程式计算氧化亚铜生成铜的质量,两部分铜的质量即为固体的质量.
(3)先根据铜元素守恒计算硝酸铜溶液中铜离子的含量,再根据题意判断晶体中铜离子的含量,从而得出硝酸铜的物质的量,总质量减去硝酸铜的质量即为水的质量,计算水的物质的量,再根据物质的量之比等于系数之比得出化学式.
解答 解:(1)n(CuO)=$\frac{8g}{80g/mol}$=0.1mol,氧元素的物质的量=n(CuO)═铜元素的物质的量=0.1mol;固体由CuO生成Cu和
Cu2O,减少的质量为氧元素的质量,即8g-6.8g=1.2g,减少的氧元素的物质的量=$\frac{1.2g}{16g/mol}$=0.075mol,所以Cu2O中氧元素的物质的量=0.1mol-0.075mol=0.025mol,所以n(Cu2O)=0.025mol,根据铜元素守恒得n(Cu)=0.1mol-2×0.025mol=0.05mol,所以单质铜与氧化亚铜的物质的量之比是2:1.
故答案为:2:1;
(2)n(Cu)=0.1mol-2×0.025mol=0.05mol,所以m(Cu)=0.05mol×64g/mol=3.2g,
氧化亚铜的质量=6.8g-3.2g=3.6g.
氧化亚铜和稀硫酸反应,铜和稀硫酸不反应,设氧化亚铜和稀硫酸反应生成铜的质量为x.
氧化亚铜和稀硫酸反应的方程式为:
Cu2O+H2SO4=CuSO4+Cu+H2O
144g 64g
3.6g x
x=1.6g
所以可得到固体的质量=3.2g+1.6g=4.8克
故答案为:4.8克.
(3)根据铜元素守恒知,氧化铜中的铜全部转化为硝酸铜中的铜离子,为0.1mol,原溶液中的Cu2+有20%残留在母液中,所以晶体中铜离子的物质的量为0.08mol,根据化学式知,晶体中硝酸铜的物质的量=铜离子的物质的量=0.08mol,
m(Cu(NO3)2)=0.08mol×188g/mol=15.04g<23.68g,所以晶体中有水,水的物质的量=$\frac{23.68g-15.04g}{18g/mol}$=0.48mol,硝酸铜与水的物质的量之比=0.08mol:0.48mol=1:6,所以其化学式为Cu(NO3)2•6H2O.
故答案为:Cu(NO3)2•6H2O.
点评 本题考查了铜及其化合物的性质,计算量较大,注意运用分析、转化的思想解题,易错题是(2)题,容易把氧化亚铜生成的铜单质漏掉而造成错误解答,侧重于考查学生的分析能力和计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 给盛有液体的烧瓶加热时,需要加碎瓷片或沸石 | |
| B. | NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热 | |
| C. | 不慎将少量浓硫酸溅到皮肤上,应立即用水冲洗,然后涂抹10%的NaOH溶液 | |
| D. | 中和滴定实验时,不必润洗锥形瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的正反应速率是Y的逆反应速率的$\frac{m}{n}$倍 | |
| B. | 通入稀有气体使压强增大,平衡将正向移动 | |
| C. | 降低温度,混合气体的平均相对分子质量变小 | |
| D. | 若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫的还原性 | B. | 硫的漂白性 | ||
| C. | 二氧化硫的还原性 | D. | 二氧化硫的漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 烃被看作有机物的母体,请完成下列与烃的知识相关的练习:
烃被看作有机物的母体,请完成下列与烃的知识相关的练习: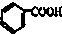 )和碱石灰的混合物得的液体命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式
)和碱石灰的混合物得的液体命名为苯,写出苯甲酸钠与碱石灰共热生成苯的化学方程式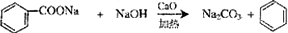

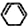 )脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).
)脱去2mol氢原子变成苯却放热,可推断苯比1,3-环己二烯稳定(填“稳定”或“不稳定”).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
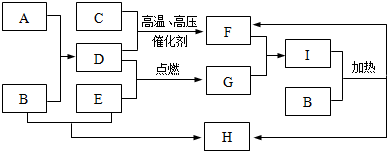
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com